新药专题|8月:两款国产自免新药获批上市,美国FDA批准吉利德小分子创新药上市…
1. 两款国产自免新药批准上市
2. 首款国产KRAS抑制剂获批上市
3. 美国FDA批准吉利德小分子创新药上市
4. 106个新药在国内获得临床试验默示许可
图1. 2024年FDA和NMPA批准的1类新药数量(按月统计)

注:美国FDA数据为药品审评和研究中心(CDER)批准的新分子实体数量,不含CBER批准的新药
数据来源:药智数据
2024年8月,美国FDA 批准了7个新药上市,包括抗肿瘤药VORANIGO、LAZCLUZE、LAZCLUZE,激素替代疗法YORVIPATH,原发性胆汁性胆管炎新药LIVDELZI,结节性痒疹新药NEMLUVIO,以及用于慢性移植物抗宿主病治疗新药NIKTIMVO。
NMPA批准了4个国产1类新药上市,包括2个抗肿瘤药氟泽雷塞片、西达基奥仑赛注射液,2个自免新药赛立奇单抗注射液和夫那奇珠单抗注射液。此外,8月还有106个1类新药在中国获批临床,获批数量持续维持在较高水平。
七款新药
FDA批准上市
2024年8月,美国FDA药品审评和研究中心(CDER)批准了7个新药,包括4个化药和3个生物药。下面简要介绍获批的这几款新药。

数据来源:FDA官网
1. VORANIGO
申报企业:SERVIER
适应症:2级星形细胞瘤或少突胶质细胞瘤
8月6日,美国FDA批准了SERVIER公司的Voranigo(vorasidenib)上市,用于手术后治疗携带易感IDH1或IDH2突变的2级星形细胞瘤或少突胶质细胞瘤的12岁及以上成人和儿童患者。
该药是一款每日口服一次的IDH1和IDH2抑制剂,在关键III期INDIGO研究中,VORANIGO显示出显著延长患者的无进展生存期和下一次干预的时间,且具有良好的耐受性。其获批为这类患者提供了一种新的治疗选择。
2. YORVIPATH
申报企业:ASCENDIS PHARMA
适应症:甲状旁腺功能减退症
8月9日,美国FDA批准了Ascendis Pharma公司的Yorvipath(palopegteriparatide)上市,用于治疗成人甲状旁腺功能减退症。
甲状旁腺功能减退症是一种罕见的内分泌疾病,其特征是甲状旁腺激素(PTH)水平不足。Yorvipath是一种每日一次长效甲状旁腺激素前体药物,旨在在24小时的给药期内将甲状旁腺激素水平恢复到正常范围并保持在该范围内。它采用TransCon技术,该技术可延长药物在体内的作用时间并允许减少给药频率。此前,该药已于2023年11月在欧盟获批上市。
3. LIVDELZI
申报企业:吉利德
适应症:原发性胆汁性胆管炎
8月14日,美国FDA批准了吉利德公司的Livdelzi(seladelpar)与熊去氧胆酸(UDCA)联合用于治疗对UDCA应答不足的原发性胆汁性肝硬化(PBC)成人患者,或作为单药治疗对UDCA不耐受的患者,但不建议患有或发展为失代偿性肝硬化的患者使用Livdelzi。
原发性胆汁性胆管炎是一种有潜在生命危险的肝脏自身免疫性疾病。Seladelpar是一款口服的过氧化物酶体增殖物激活受体δ(PPARδ)的选择性激动剂,PPARδ是一种核受体,能调节基因参与的脂质储存和运输(尤其是脂肪酸氧化),以及胰岛素的信号传导和敏感性。
该药由CymaBay Therapeutics开发,吉利德于今年2月与该公司达成总金额达43亿美元的收购协议,获得了这款新药,半年后该药顺利获得美国FDA批准上市,用于治疗原发性胆汁性肝硬化。
4. LAZCLUZE
申报企业:强生
适应症:非小细胞肺癌
8月19日,美国FDA批准了强生的Lazcluze(lazertinib)联合其EGFR/MET双特异性抗体Rybrevant(amivantamab),用于一线治疗经美国FDA批准检测证实带有EGFR外显子19缺失或外显子21中L858R替代突变的局部晚期或转移性非小细胞肺癌(NSCLC)成年患者。
Lazertinib是一种高选择性、可穿透血脑屏障的第三代口服EGFR TKI。该药最早于2021年在韩国获批上市,商品名Laclaza。 本次在美国获批的是与强生EGFR/MET双抗Rybrevant的组合疗法,该组合疗法也成为首个也是唯一一个多靶点、无化疗组合疗法,且在EGFR突变NSCLC一线治疗中表现出优于奥希替尼。
5. LYMPHIR
申报企业:CITIUS PHARMS
适应症:T细胞淋巴瘤
8月7日,美国FDA批准Citius Pharmaceuticals公司的Lymphir(denileukin diftitox)上市,用于治疗至少接受过一种全身治疗的复发/难治性皮肤T细胞淋巴瘤(r/r CTCL)患者。
CTCL是一种罕见且常使人衰弱的慢性非霍奇金淋巴瘤,主要影响皮肤。Lymphir是一种新型免疫疗法,也是首款靶向恶性T细胞和调节性T细胞(Tregs)上的白细胞介素-2(IL-2)受体的CTCL疗法。
6. NEMLUVIO
申报企业:GALDERMA
适应症:结节性痒疹
8月12日,美国FDA批准Galderma公司的Nemluvio(nemolizumab)上市,用于治疗成人结节性痒疹患者。
结节性痒疹是一种神经免疫性皮肤病。Nemolizumab是一种人源化单克隆抗体,靶向阻断IL-31受体A。IL-31是一种诱导瘙痒的细胞因子,与特应性皮炎和透析患者瘙痒的发生有关。该药由中外制药原研,采用了其专有的抗体工程化技术ACT-Ig创造,能够延长抗体在血液中的生物学半衰期。该药之前已在日本获批用于治疗儿童、青少年和成人患者的结节性痒疹以及与特应性皮炎相关的瘙痒,商品名Mitchga,本次在美国获批用于治疗成人结节性痒疹患者。
7. NIKTIMVO
申报企业:INCYTE
适应症:慢性移植物抗宿主病
8月14日,美国FDA批准Incyte公司和Syndax Pharmaceuticals联合开发的抗体疗法Niktimvo(axatilimab)上市,用于治疗慢性移植物抗宿主病(cGVHD)成人和体重40公斤以上的儿科患者。
cGVHD是源于供体的血细胞对接受移植患者组织产生的免疫反应。Niktimvo是首个获得批准的针对慢性GVHD炎症和纤维化驱动因素的抗CSF-1R抗体。它通过抑制CSF-1受体信号传导,减少与疾病相关的巨噬细胞及其单核细胞前体细胞的数量。
四款新药
NMPA批准上市
2024年8月,中国国家药品监督管理局(NMPA)批准了4个国产1类新药上市,详情见表2。

数据来源:国家药监局官网、药智数据
1. 氟泽雷塞片
申报企业:信达生物
适应症:非小细胞肺癌
氟泽雷塞片是信达生物和劲方医药合作开发的一款特异性共价不可逆的 KRAS G12C 抑制剂,获NMPA批准用于至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌 (NSCLC)成人患者。
该药最初由劲方医药开发。2021年9月,信达生物以3.12亿美元总价从劲方医药手里引进,获得了氟泽雷塞在中国地区的开发和商业化权利,并拥有全球开发和商业化权益的选择权。
NSCLC发病人群占所有肺癌患者的85%,KRAS突变又是最常见NSCLC驱动基因突变之一;G12C突变型在KRAS突变NSCLC患者当中占比最高。目前美国市场已有安进的Sotorasib和BMS的Adagrasib两款KRAS抑制剂获批上市,氟泽雷塞片是中国首个获批的KRAS G12C抑制剂,为国内KRAS G12C突变型晚期非小细胞肺癌成人患者提供了新的治疗选择。
2. 西达基奥仑赛注射液
申报企业:传奇生物
适应症:多发性骨髓瘤
西达基奥仑赛(ciltacabtagene autoleucel),简称为Cilta-cel,是一种靶向BCMA的经基因修饰的自体T细胞治疗产品,该产品通过编码嵌合抗原受体(CAR)对自体T细胞进行修饰,使其能识别并清除表达BCMA的骨髓瘤细胞。
2017年12月,传奇生物与强生旗下杨森公司签订了一项全球独家许可与合作协议,以研发和商业化西达基奥仑赛。2022年2月28日,美国FDA 批准了该药上市,用于治疗复发或难治性多发性骨髓瘤成人患者,商品名CARVYKTI。本次在中国获批上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂),商品名卡卫荻,为国内多发性骨髓瘤患者带来新的治疗选择。
3. 夫那奇珠单抗注射液
申报企业:恒瑞医药
适应症:中重度斑块状银屑病
夫那奇珠单抗注射液(安达静)是恒瑞医药自主研发的一款重组抗IL-17A人源化单克隆抗体,获NMPA批准用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病成人患者。
银屑病是一种自身免疫性皮肤病,IL-17A是已经过验证的治疗药物靶点。其中诺华的司库奇尤单抗(Secukinumab)是第一个特异性靶向IL-17A的全人源单克隆抗体,2023年销售额近50亿美元,位列自免畅销药前十行列。恒瑞医药的夫那奇珠单抗是中国首个获批的本土自主研发重组抗IL-17A人源化单克隆抗体,将打破同类进口药物的长期垄断局面,为银屑病患者提供新的治疗选择。
4. 赛立奇单抗注射液
申报企业:中重度斑块状银屑病
适应症:智翔金泰
赛立奇单抗注射液是智翔金泰开发的一款重组全人源抗IL-17A单克隆抗体,是国内首个全人源IL-17A靶点药物。
智翔金泰的赛立奇单抗注射液与恒瑞医药的夫那奇珠单抗同为IL-17A靶点药物,且同日获得NMPA批准用于中重度斑块状银屑病的治疗。两款国产银屑病新药的获批,打破了同类进口药物的长期垄断局面,为中国银屑病患者带来治疗新选择。
106款新药
国内获批临床
2024年8月,有106个1类新药在中国获得临床试验默示许可,包括91个国产新药和15个进口新药,获批数量与上月持平,但同比去年8月大幅增长。
图1. 2022-2024年获批临床的1类新药数量
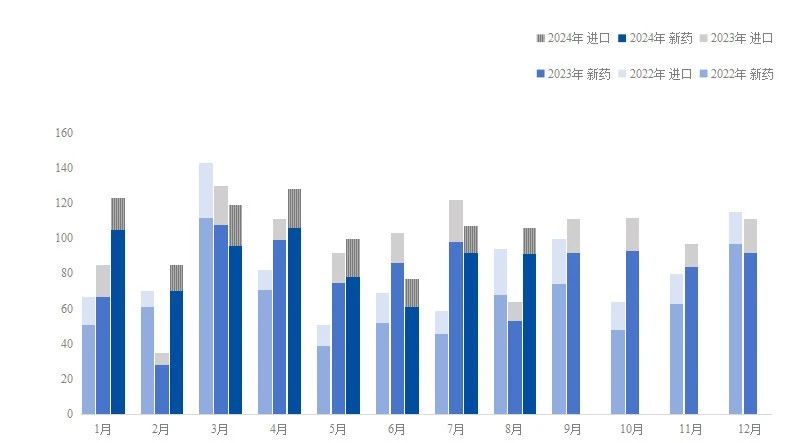
数据来源:国家药监局官网、药智数据
从药物类型看,小分子占比约50%,小核酸、蛋白降解剂、放射性治疗药物、ADC、PDC等新型药物类型也逐渐进入收获期,多个新药获批临床。
从适应症看,实体瘤是新药开发最热门的领域,其次为自身免疫性疾病,多个新药获批开展银屑病、特应性皮炎、干燥综合征等自免疾病的临床试验。

数据来源:国家药监局官网、药智数据
表4. 2024年8月国内获批临床的进口新药(部分)

数据来源:国家药监局官网、药智数据
小结
获批上市新药
8月,中美药品监管机构都批准了多个新药上市。
在美国,三款抗肿瘤新药获得批准上市,包括VORANIGO、LAZCLUZE、LAZCLUZE,涵盖胶质瘤、皮肤T细胞淋巴瘤和非小细胞肺癌多个癌种。此外,甲状旁腺功能减退症患者迎来长效激素替代疗法Yorvipath,原发性胆汁性胆管炎、结节性痒疹,以及慢性移植物抗宿主病患者也都迎来了新的治疗药物。
在中国,NMPA批准了首款国产KRAS抑制剂上市,为非小细胞肺癌患者带来新的选择。NMPA还批准了两款国产银屑病单抗上市,填补了国产自免生物制剂领域空白,为患者带来更实惠的选择。
获批临床新药
8月份国内获得了临床试验默示许可的新药与上个月持平,但首次获批临床的比例较上个月略有下降。适应症方面,实体瘤最多,其次为自身免疫性疾病,包括多个银屑病、特应性皮炎新药获批临床。另外代谢疾病也是新药研发的热门领域,包括非酒精性脂肪性肝病、糖尿病等。

责任编辑:青霉素
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。




合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



