2019年第3季度FDA批准新药汇总及评述
2019年第3季度,FDA药品审评与研究中心(CDER)批准了14个新药,同比下降33.33%。这些新药包括新药申请NDA中的新分子实体(NME)和生物制品许可申请(BLA)。
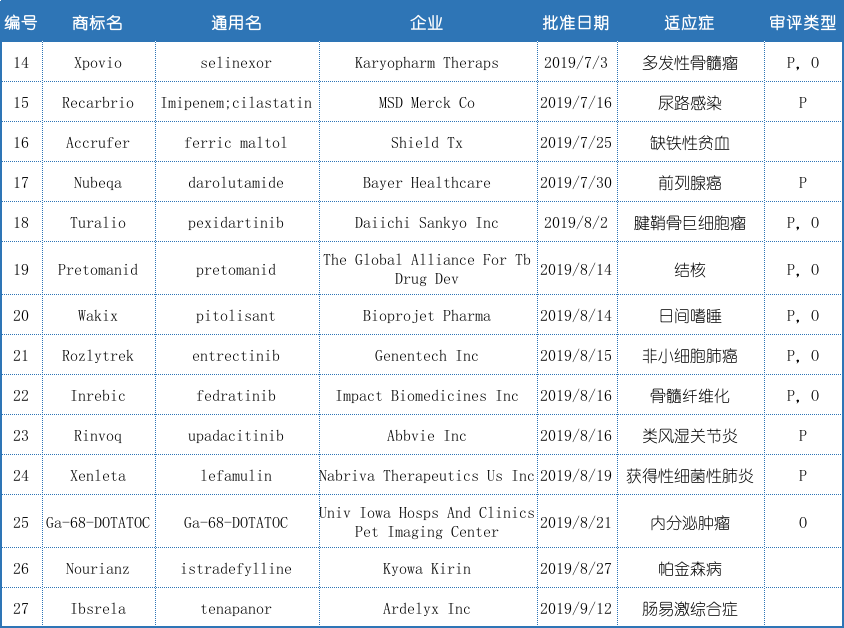
表1:2019年第3季度批准的新药汇总
罕见病/孤儿药(RareOR“Orphan”Diseases)
2019第3季度已批准的14个新药中,7个新药获得了孤儿药资格(O),占CDER批准新药的50%。罕见病有两个特征,其一为患者人数少(美国为少于20万人的疾病;欧盟为属于5/10000的疾病);其二为危及生命和健康的严重疾病。
优先审评(PriorityReview)
如果CDER确定药品能够有潜力对医疗保健做出实质性推动,药品将获得优先审评。药品在6个月内而不是标准的10个月内审评。2019年第3季度获批新药中有10个被认定为优先审评(P),占批准新药的71.43%。
CDER应用多种监管方法加快新药研发和审批。这些方法除了优先审评还包括:快速通道(FastTrack)、突破性治疗认定(Breakthrough)和加速批准(AcceleratedApproval)。
CDER近10来批准的新药数均在20个以上,2018年最多,达到59个。2019年前三季度CDER共批准新药27个,同比有些下降。
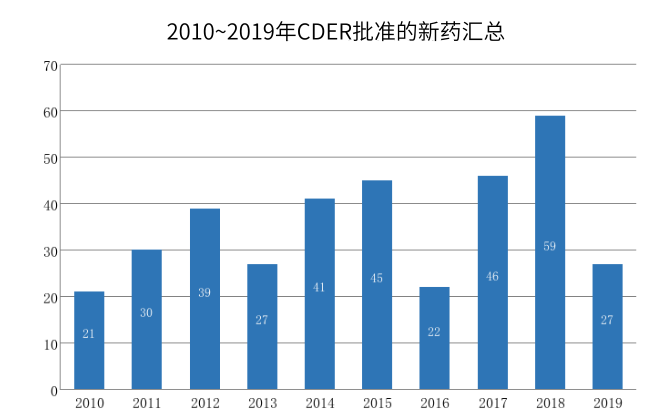
图1:2010~2019年CDER批准的新药汇总
重点品种评述
Xpovio(selinexor)
7月4日,KaryopharmTherapeutics宣布FDA批准Xpovio(selinexor)联合地塞米松用于复发或难治性多发性骨髓瘤的成人患者。这些患者已接受过四次或更多次治疗,且对至少两种蛋白酶体抑制剂、至少是两种免疫调节剂和抗CD38单克隆抗体来说是难治的。
此次批准是基于Ⅱb期STORM试验的亚组分析结果,该研究的第2部分共涉及122名患者,包括83名患有硼替佐米难治的患者。该亚组的总体反应率为25.3%,这些患者首次应答的中位时间为4周,而中位持续时间为3.8个月。
Recarbrio(Imipenem;cilastatin;relebactam)
7月16日,默沙东宣布旗下新型抗生素Recarbrio已经获得FDA批准,用于治疗复杂性尿路感染(cUTI)和复杂性腹腔内感染(cIAI)。为了降低细菌的耐药性并保证Recarbrio和其他抗菌药物的有效性,Recarbrio仅被批准用于治疗或预防已确诊的由易感细菌引起的感染。
Recarbrio是Imipenem(亚胺培南)和cilastatin(西司他丁)和relebactam(瑞来巴坦)的组合。亚胺培南是青霉烯抗菌药,西司他丁是肾脱氢肽酶抑制剂,瑞来巴坦是β内酰胺酶抑制剂。西司他丁限制亚胺培南的肾脏代谢,并且不具有抗菌活性。
亚胺培南在肠杆菌科和铜绿假单胞菌中与PBP2和PBP1B结合,进而抑制青霉素结合蛋白(PBPs),PBPs的抑制作用会导致破坏细菌细胞壁的合成。
瑞来巴坦没有内在的抗菌活性,但可保护亚胺培南免受某些丝氨酸内酰胺酶的降解,如巯基变异型酶(SHV)、替莫尼拉(TEM)、头孢他昔单胺酶(CTX-M)、阴沟肠杆菌P99(P99)、假单胞菌源性头孢菌素酶(PDC)和肺炎克雷伯菌碳青霉烯酶(KPC)。
Nubeqa
7月30日,拜耳宣布美国食品和药物管理局(FDA)批准Nubeqa®(darolutamide),用于治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者。
Darolutamide由拜耳和芬兰医药公司OrionCorporation联合开发。拜耳已经在欧盟(EU),日本和其他国家提交了Darolutamide的上市申请。FDA的批准是基于评估Nubeqa加雄激素剥夺疗法(ADT)在Ⅲ期ARAMIS临床试验中的表现,该试验证明无转移生存(MFS)的主要疗效终点有显著改善。与安慰剂加ADT疗法相比,Darolutamide治疗组患者的中位无转移生存期为40.4个月,而对照组为18.4个月。
Darolutamide是一种非甾体雄激素受体拮抗剂。它具有独特的化学结构,能够与抑制雄激素受体(AR)以高亲和力结合,并且表现出强力的拮抗活性。因此,它可以抑制雄激素受体功能和前列腺癌细胞的增殖。
Turalio(pexidartinib)
8月2日,美国FDA宣布,已批准DaiichiSankyo的CSF1抑制剂Turalio(pexidartinib)用于治疗手术改善无效的成人症状性腱鞘巨细胞瘤(TGCT)。
这项批准是基于来自120名症状性晚期TGCT患者的随机III期ENLIVEN试验的数据,主要终点是治疗25周后的总反应率(ORR)。结果显示,Turalio治疗组的ORR达到了38%,显著高于安慰剂组。Turalio治疗组的CR和PR率分别为15%和23%。
pretomanid
8月15日,美国FDA宣布,批准由非盈利组织全球结核病药物开发联盟(TBAlliance)开发的pretomanid上市,与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联用,治疗特定高度耐药肺结核(TB)患者。这是近40年来FDA批准的第三款抗肺结核新药,也是第一款由非盈利组织开发并且上市的肺结核新药。
Pretomanid是一种新化学实体。它与贝达喹啉和利奈唑胺构成的组合疗法的疗效在名为Nix-TB的关键性临床试验中获得了证明。参加这一试验的109名患者包括广泛耐药性TB患者,和对已有疗法不耐受或无反应的多重耐药性患者。试验结果表明,在接受治疗6个月之后,这一组合疗法的成功率达到89%,显著高于治疗广泛耐药TB患者的历史成功率。
Inrebic(fedratinib)
8月19日,新基(Celgene)宣布,FDA已批准高度选择性JAK2抑制剂Inrebic(fedratinib),用于中危-2和高危(intermediate-2/high-risk)原发性或继发性(红细胞增多症后或原发性血小板增多症后)骨髓纤维化成人患者的治疗。Inrebic通过FDA的优先审查程序获得批准,之前还被授予了孤儿药资格。骨髓纤维化是一种严重的骨髓疾病,会破坏人体正常的血细胞生成。
此次批准,使Inrebic成为近十年来美国FDA批准的首个骨髓纤维化新药,将为患者提供一种新的每日一次的口服治疗选择。2011年,诺华公司的JAK1/JAK2抑制剂Jakafi(ruxolitinib)获得FDA批准,成为首个治疗骨髓纤维化的药物。
Xenleta(lefamulin)
8月20日,NabrivaTherapeutics宣布,FDA已批准Xenleta(lefamulin)静脉注射制剂和口服制剂,用于成人治疗社区获得性细菌性肺炎(CABP)。Xenleta2种制剂均通过FDA的优先审查程序获得批准,之前均被授予了合格传染病产品(QIDP)资格和快速通道资格。
值得一提的是,Xenleta是近二十年来FDA批准的第一款具有新作用机制的静脉注射和口服抗生素,对CABP成人患者而言,代表了一种重要的、新的、短期的、经验性的单药治疗方案。
Xenleta的批准,基于2项关键性Ⅲ期临床研究(LEAP-1,LEAP-2)的数据。这2项研究评估了静脉注射制剂和口服制剂Xenleta相对于莫西沙星(moxifloxacin)治疗CABP成人患者的疗效和安全性。LEAP-1研究设计为可选择从静脉注射制剂转为口服制剂,评估了Xenleta静脉/口服治疗5-7天与莫西沙星静脉/口服治疗7天(有或无利奈唑胺)的疗效,2个治疗组在3天后都可以选择从静脉/口服转为口服。LEAP-2研究设计为一个短疗程口服Xenleta,评估了Xenleta口服5天与莫西沙星口服7天的疗效。LEAP-1研究中,Xenleta疗效与莫西沙星(有或无利奈唑胺)相当;LEAP-2研究中,Xenleta治疗时间较莫西沙星少2天但疗效相当。2项研究中,Xenleta均被证明非劣效于莫西沙星,并且符合FDA和EMA治疗CABP的主要和次要疗效终点。研究中,Xenleta静脉注射制剂和口服制剂均表现出良好的耐受性。
Nourianz(istradefylline)
8月28日,美国FDA宣布,批准协和麒麟(KyowaKirin)株式会社开发的创新药Nourianz(istradefylline)上市,作为左旋多巴/卡比多巴的辅助疗法,治疗经历“关闭”期(“off”episodes)的帕金森病(Parkinson’sdisease,PD)成人患者。“关闭”期时患者的药物作用不佳,导致PD症状加剧,包括震颤和行走困难。Istradefylline是一种选择性腺苷A2A受体拮抗剂。协和麒麟曾在2007年向美国FDA递交这款新药的上市申请,然而没有获得批准。10余年之后,这款新药终于获批,有望帮助改善PD患者的生活质量。
Istradefylline治疗处于“关闭”期PD患者的疗效,在总计包含1143名患者的4项含安慰剂对照的临床试验中得到验证。这些患者都在使用左旋多巴/卡比多巴。在这四项试验中,接受istradefylline治疗的患者每天经历“关闭”期的时间与安慰剂组相比得到统计显著缩短。
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

• 一致性评价进展报告!齐鲁制药过评最多、阿莫西林呈最受欢迎品种…
• 2001个受理号!一文了解一致性评价最新进展...
• 1季度中国药企获FDA批准的ANDA分析!正大天晴、南京健友、东阳光…
• 最受欢迎的一致性评价品种排行榜!阿莫西林、苯磺酸氨氯地平…
• 受理号达538个!一致性评价过评企业排行榜
• 16家企业过评,盐酸二甲双胍片一致性评价进度分析
• NMPA发布的2446条参比制剂目录分析,CDE首次公示未通过审议参比制剂
• 2019年仿制药一致性评价进展报告
• 2019国内药物临床试验CTR排行榜!江苏恒瑞、正大天晴…
• 2019 CDER批准新药排行榜!诺华、艾伯维、基因泰克、第一三共...
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





