千亿市场的下一站:新靶点的幻象,还是老靶点的疆场?
当GLP-1凭借“单靶点撬动千亿市场”的神话点燃行业对新靶点的追逐热情时,司美格鲁肽年销售额突破200亿美元的成绩,让“押注新靶点=抢占未来赛道”成为无数企业的默认战略。
然而,转头看向ESMO、ASCO等全球顶级肿瘤大会,研发风向却呈现出截然不同的场景--没有“奇迹靶点”的集中爆发,反而满是老靶点通过技术迭代、场景延伸焕发新生的案例。
这种看似分裂的现象,究竟是行业认知的偏差?还是医药创新从“野蛮生长的单点突破”迈入“精细化深耕的系统竞争”的信号?
事实上,无论是新靶点的冒险探索,还是老靶点的疆域拓展,本质都是服务于“未被满足的临床需求”。或许,当光环褪去后,行业更需要冷静思考:下一个千亿市场的开启,到底该依赖“从零到一”的新靶点突破,还是“从一到N”的老靶点升级?
新靶点:“逆天改命”的幻想与现实落差
GLP-1的成功像一剂强心针,让整个行业陷入“新靶点迷信”——仿佛只要找到下一个“GLP-1”,就能复制千亿传奇。
据Nature上发布的《2024年中国创新药研发趋势》内容显示,2024年中国在研创新药管线中,新靶点数量从2021年的375个增至670个,近乎翻倍,预计对应的研发投入占比也呈逐年上涨的趋势。
但理想之外,现实很快给这份狂热浇了冷水:新靶点的研发之路,远比想象中崎岖难行。
① 验证难度大
在新药研究中,新靶点的最大风险在于其“基础研究与临床现实的脱节”。尽管多数新靶点的有效性在细胞或动物模型中极具潜力,但一旦进入人体实验,却往往会因“病理机制差异”或“脱靶效应”而折戟沉沙。
比如曾被寄予厚望的TIGIT靶点,具备与放化疗、分子靶向药联用对抗癌症潜力,一度被视为是下一个“PD-1”,诱人的市场前景也因此吸引了诸多药厂入局,罗氏、默沙东、BMS、诺华等MNC皆竞相投身其中。可结果,大量的临床投入之下却并没有换来相应的产出,反而随着临床试验的深入,TIGIT靶点药物实际疗效和安全性问题愈发凸显,失败也接二连三的到来。
2022年,罗氏作为TIGIT单抗领域的标志性药物的Tiragolumab遭遇失败,成为全球首个TIGIT Ⅲ期临床失败案例。
2023年,诺华基于多方面综合评估,决定终止从百济神州引进的Ociperlimab相关合作,同时百济神州也终止了该药Ⅲ期临床研究AdvanTIG-301,仅保留AdvanTIG-302研究。
2023年,BMS宣布终止其抗TIGIT药物BMS-986207的Ⅱ期临床试验,并于2024年宣布退出与Agenus的TIGIT合作项目,并“退货”了已经支付了2亿美元预付款的TIGIT双特异性抗体AGEN1777。
2024年,默沙东宣布,TIGIT单克隆抗体Vibostolimab与K药联合治疗黑色素瘤的Ⅲ期临床因免疫副作用而终止,并于同年12月宣布彻底终止Vibostolimab的临床开发项目。
自此,TIGIT靶点彻底陷入了至暗时刻,仅有少数管线还在活跃。而放眼整个新药研发领域,这种“临床失败”并非个例,据《Nature Reviews Drug Discovery》统计,2024年全球新靶点药物的临床Ⅱ期失败率高达68%,是老靶点药物的1.8倍以上。
② 商业性价比不足
当然,新靶点药物研发也不乏成功案例,但即使挺过成药性验证难关,上市阶段也同样存在因“适用人群狭窄”而陷入的商业瓶颈。
与GLP-1这样的跨时代产物不同,绝大多数新靶点对应的标签往往都是“罕见突变”或“小众疾病”,其市场规模注定难以支撑“千亿幻想”,以METex14跳变为例,其在NSCLC中的发生率仅3%~4%,对应全球患者约15万人,即便药物定价为每年10万美元,全球市场规模也不足150亿美元;另一新靶点CD200R1针对精神分裂症认知障碍,虽患者基数较大,但因“疗效边界模糊”,上市后年销售额仅突破5亿美元,远不及老靶点药物的零头。
更关键的是,新靶点药物的研发成本极高,一款新靶点药物从发现到上市的平均成本超20亿美元,远超老靶点药物,且研发周期长达12-15年——这意味着,即便药物成功上市,也需要在短时间内实现大规模销售才能收回成本。
但现实是,新靶点药物的市场教育周期长,医生接受度低,往往需要3-5年才能达到销售峰值,进一步加剧了商业化压力。
老靶点的新武器
与新靶点的“高风险”形成鲜明对比,在近两年的ESMO、ASCO等一线会议之上,越来越多老靶点正在通过“技术复合+人群拓展”等手段,打破传统应用边界,尝试激活新的增量空间,核心思想正是“以成熟靶点为基石,用创新手段拓展其统治疆域”。
① 技术复合:给老靶点装上“协同增效”的引擎
有目共睹,历史上没有哪款新药产品能长盛不衰,但与此同时,市面上也不乏拥有长久生命线的创新产品,比如曾经的K药、修美乐、Entresto等。
而其中,上述产品的长生命周期却并非依赖“新靶点突破”,而是精准抓住了“技术复合”的核心逻辑——以成熟老靶点为基石,通过与新技术、新机制的协同组合,不断突破疗效天花板、拓展治疗边界,让老靶点在迭代中持续释放增量价值。
以PD-1/PD-L1为例,其作为肿瘤领域的“老王牌”,近年来的单药红利已明显下行,要想继续巩固其原有市场,选择与双抗、ADC等新技术结合,使疗效与适用范围大幅拓展就是绝大多数IO平台型公司的不二法门。这一点,在前几日刚结束的ESMO2025大会上,其议程类型中也清晰表明。甚至可以说,下一个新药领域的重大突破或将依赖于“免疫检查点抑制剂+X”的复合疗法(IO+ADC、IO+双抗等)。
就IO+ADC而言,会上多个专场积极探讨了ADC与免疫检查点抑制剂的协同作用,其中具有代表意义当属阿斯利康在会上带来了两项关于IO+ADC的研究( BEGONIA、TROPION-PanTumor03)。
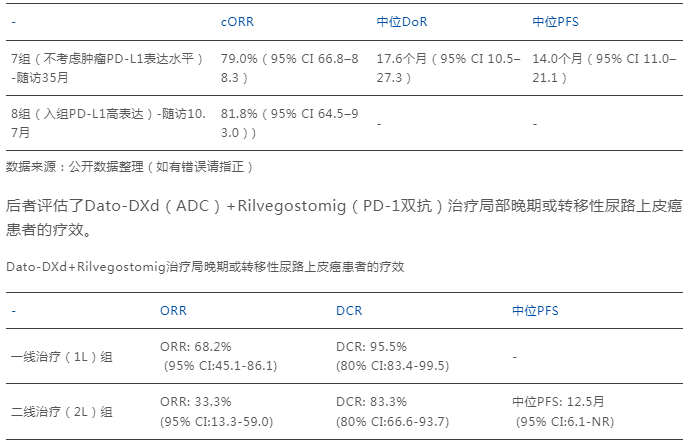
前者评估了Dato-DXd(ADC)+度伐利尤单抗(PD-1单抗)治疗经治不可切除、局部晚期或转移性三阴性乳腺癌的疗效。
Dato-DXd+度伐利尤单抗治疗晚期或转移性三阴性乳腺癌的疗效
数据来源:公开数据整理(如有错误请指正)
图片来源:医脉通(点击查看大图)
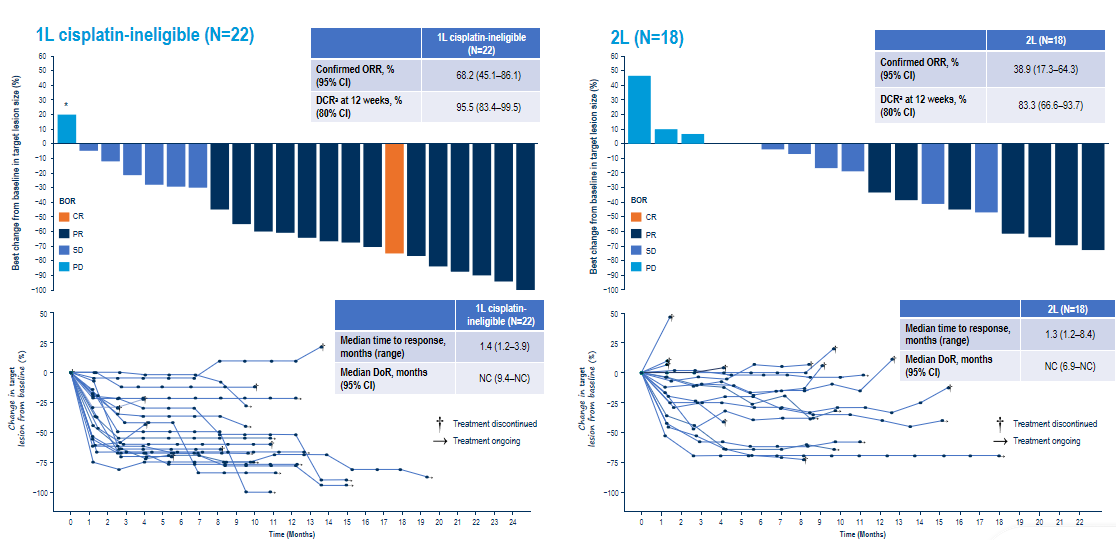
临床意义层面,以Dato-DXd+Rilvegostomig为例,在现有晚期或转移性尿路上皮癌的临床治疗中,虽仍以含铂化疗作为一线标准治疗,但其疗效有限,中位总生存期(OS)仅约15个月。
而近年来,众多创新疗法的出现逐渐改善了部分患者的生存结局,比如免疫检查点抑制剂将患者ORR数据提升至20%–30%,以Dato-DXd为代表的ADC产品,将ORR提升至25.0%,中位PFS为6.9个月。但纵然如此,晚期或转移性尿路上皮癌治疗领域仍存在多数患者无持久生存获益,且原发或继发耐药普遍存在的临床痛点。
而此次Dato-DXd+Rilvegostomig的联合疗法结果显示,在1L队列中(未接受过系统治疗),确认的ORR达到了68.2%,相较于Dato-DXd单独治疗(25%)、PD-1单独治疗(20%~30%)均有显著提升。
这说明,“ADC精准递药+免疫调控”的联合策略具有显著的潜在临床价值,新药研发除靶向创新之外,或许也存在免疫协同的多维度发展。
② 人群拓展:从“精准窄众”到“广谱覆盖”的突破
一般情况下,传统老靶点药物多聚焦于“靶点高表达”或“特定突变”人群,而“低表达、泛突变、多癌种”人群的需求长期却被忽视,而如今逐渐流行的人群拓展恰好正是老靶点疆域拓展的核心增量空间。
以KRAS靶点为例,2021年,随着安进的AMG 510与Mirati的MRTX849先后获批用于KRAS G12C突变晚期非小细胞肺癌(NSCLC),KRAS“不可成药”的神话虽终被打破,然而,第一代抑制剂除破冰意义之外,其局限性也同样明显:
突变覆盖窄:过去的KRAS抑制剂仅针对G12C这一种亚型,而占KRAS突变总数超60%的G12D、G12V等亚型仍无药可治,大量患者被排除在外。
耐药出现迅速:数据显示,患者使用Sotorasib或Adagrasib的中位无进展生存期(PFS)仅6-8个月,耐药机制包括KRAS二次突变(如G12C→G12D)、旁路信号激活(如EGFR、MET扩增)等。
单药疗效有限:传统KRAS抑制剂单药治疗的客观缓解率(ORR)约30%~40%,且对胰腺癌、结直肠癌等“冷肿瘤”的效果较差,难以满足临床对高疗效的需求。
因此,对于KRAS抑制剂领域而言,与其花费大量人力、财力去开发新靶点药物,继续深耕新一代抑制剂的研发不失为策略之一。而在ESMO 2025大会上,除常规G12C突变新药的临床研究外,泛KRAS、KRAS G12D、KRAS G12V抑制剂也成了大会热议的话题。
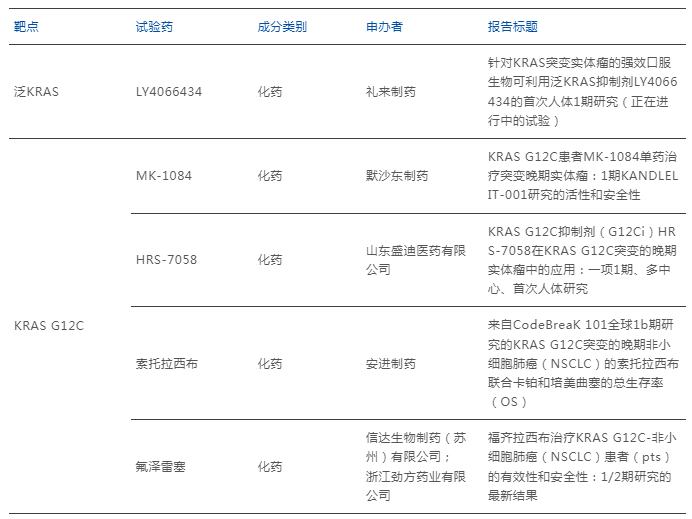
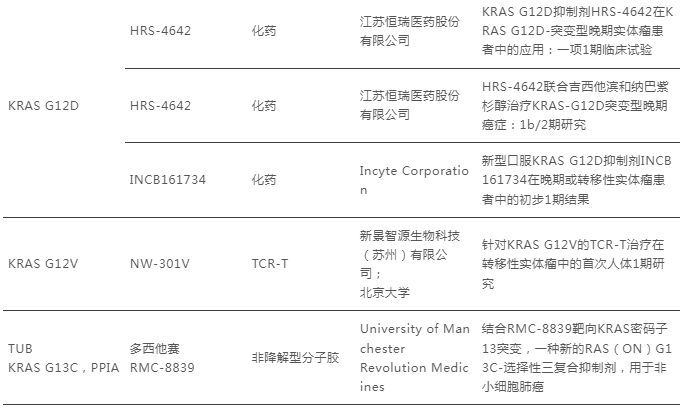
数据来源:ESMO 2025大会
而KRAS靶点之外,HER2低表达也是大会上“靶点下沉”的另一典型案例。近年来,随着新型ADC药物的问世,HER2低表达(HER2-low)乳腺癌逐渐成为新的乳腺癌治疗分型,这个曾经“不可成药”的市场也顺势成为众多药企必争之地。
在ESMO 2025的议程中,众多相关研究进一步验证了“靶点低表达(-low)”概念的临床价值,又一个百亿市场即将面世。
百利天恒:T-Bren单药在整体人群中表现均优异,尤其在HR+/HER2低表达患者中展现出色疗效:患者cORR达72.4%,且患者中位缓解持续时间(DOR)超过1年,达13.7个月;患者疾病控制率(DCR)达94.8%,在HR+/HER2-亚组中更是高达95%,几乎所有患者均能获得良好的肿瘤控制;患者CBR达85%,彰显出强效持久的肿瘤控制潜力。
恒瑞医药:ESMO 2025大会上,SHR-A1811联合阿得贝利单抗治疗HR阴性/HR低表达、HER2低表达转移性乳腺癌的最新临床研究得以公布,已确认疗效的患者中,11例达到部分缓解(PR),7例达到疾病稳定(SD)。初步统计显示,ORR为57.89%(19例中11例),DCR为94.74%(19例中18例)。
很明显,现阶段新药研发的标准范式已变,继新靶点追逐之后,老靶点下沉正在打破传统应用边界,激活存量靶点的增量空间,成为了全新的选择。
新靶点VS老靶点:并非对立,应是适配
当然,严格意义上讲,频繁强调老靶点的“疆域拓展”,并非否定新靶点的价值。至少就现阶段而言,新靶点仍是解决“未被满足医疗需求”的关键,比如阿尔茨海默病的Aβ靶点、渐冻症的SOD1靶点,这些领域尚无成熟疗法,新靶点是唯一希望。
但行业需要跳出“非此即彼”的思维,认识到两者各有优势,适配不同的企业战略与疾病领域。
正如前文所讲,老靶点的核心优势在于“研发与商业化的高确定性”,其作用机制、耐药路径已被充分验证,企业无需投入大量资源进行基础研究,只需针对“疗效短板”或“场景空白”优化;而新靶点的最大吸引力在于其“先发优势”与“独占市场”,若能成功开发首个针对新靶点的药物,企业可垄断市场数年。
但同时两者缺点也尤为显著,老靶点商业化竞争激烈,需要“突破性疗效”才能脱颖而出,且或可存在“机制天花板”,继而限制疗效;新靶点则除了上述的“临床失败率高”“商业化规模小”等,还面临“专利壁垒”与“技术迭代”的挑战。
那么如何把握两者之间的平衡点就是现阶段诸多药企的必修课。
而在平衡把握方面,诸多实力强劲的技术平台型企业做得较好,其将新靶点与老靶点两者模式进行了融合(老靶点+新技术),将老靶点作为新技术平台的练兵场,逐步验证ADC、双抗、PROTAC等新技术平台,而待技术成熟后再继续拓展至一些意向新靶点。这样既降低了新技术的研发风险,又为未来的新靶点布局奠定基础,成为企业平衡“创新”与“稳健”的优选。
ADC技术就是最显著的代表。早期ADC药物多针对HER2、CD20等老靶点——罗氏的T-DM1(HER2 ADC)通过HER2老靶点验证了“单抗-载荷偶联”的可行性,后续才拓展至新靶点Claudin 18.2;阿斯利康的DS-8201(HER2 ADC)则通过优化载荷与linker,在HER2老靶点上实现了“疗效突破”,进而将技术平台应用于TROP2、B7-H3等新靶点。如今,ADC技术已成为肿瘤领域的核心创新方向,2024年全球ADC市场规模突破200亿美元,而这一切的起点,正是老靶点的验证。
小结:风口之外,唯有“需求导向”的协同创新
综合而言,未来的医药行业不再有“单一风口”,下一个千亿市场的开启,既不会是“新靶点的独舞”,也不会是“老靶点的独唱”,而是两者基于“临床需求”的协同创新。
对于“无药可治”的疾病(如阿尔茨海默病、ADA与渐冻症等),纵然新靶点风险再大,市场再小,其仍是唯一的希望,而对于“已有成熟疗法”的疾病(如肺癌、乳腺癌、糖尿病),短期来看老靶点的“疆域拓展”则仍将是主流,领域内患者的需求不再是“有药可用”,更是“用好药”,靶点下沉的意义也自然更加显著。
当然,除此之外,企业的发展也更在于理性地“选择最适合自己的战场”,理解以“老靶点验证新技术”的智慧,以成熟靶点为基石,打磨ADC、双抗、PROTAC等创新利器,在降低研发风险的同时,为最终攻克全新靶点积蓄力量或许更有意义。
最终,医药创新的核心永远是“临床需求”——无论是新靶点的“从零到一”,还是老靶点的“从一到N”,只要能解决患者的痛苦,就是有价值的创新。下一个医药市场的风口,不在“新”与“老”的标签里,而在对临床需求的深度洞察中,这或许就是ESMO、ASCO大会传递的核心信号,也是医药行业回归“以患者为中心”的本质体现。
参考来源
1. HR+/HER2-low早期乳腺癌临床病理特征及风险预测模型的多中心研究
2. 《2025年欧洲肿瘤内科学会》摘要
3. ESMO 2025感想:肿瘤治疗进入联合制胜时代,T-Bren问鼎HER2ADC,微康知音,2025年10月20日
4. ESMO 2025丨KRAS G12D/V靶向治疗全面破局,四大研究改写实体瘤治疗格局,肿瘤瞭望消化时讯,2025年10月20日
5. Sun Young Rha, et al. Datopotamab deruxtecan (Dato-DXd)+Rilvegostomig (Rilve) in patients (pts) with locallyadvanced or metastatic urothelial cancer(a/mUC): Results from the phase ll TROPIONPanTumor03 study.2025 ESMO.3072MO

责任编辑:惜姌
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





