苯磺酸氨氯地平片一致性评价最新进度分析
说到一致性评价最受关注的药品,首先想到的就是苯磺酸氨氯地平片,其长期雄踞申报榜第一。
简述
苯磺酸氨氯地平最初由Pfizer公司研发,最早于1989在英国上市片剂Istin、比利时上市胶囊剂Amlor;1992年,美国FDA以Newmolecularentity(NME)批准NORVASC,规格为2.5mg、5mg、10mg;FDA橙皮书中三个规格均为参比制剂,其中10mg为标准制剂。
苯磺酸氨氯地平片主要用于高血压和冠心病,现有国产批准文号66个,其中5mg的59个,2.5mg的4个,10mg的3个;进口文号5个(2个分包装)均为5mg。
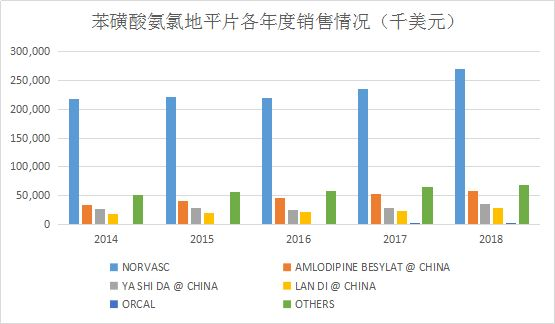
市场方面,IMS销售数据显示,苯磺酸氨氯地平片国内市场较好,2018年就达到4.6亿美元,且有稳步上升的趋势,大多销售额被辉瑞制药的络活喜占有,如2018年占比达到59%。
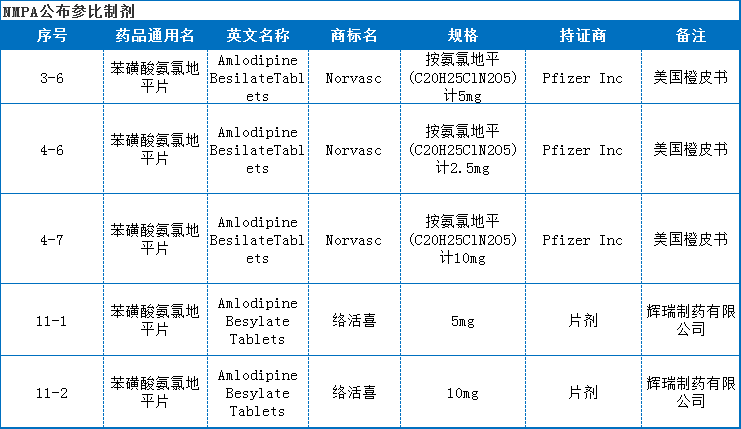
参比制剂信息
首先我们来看NMPA公布的参比制剂,由于这个品种的原研比较明确,国内只有辉瑞的地产化品种,无原研进口药,NMPA选择了美国橙皮书的Norvasc和辉瑞的原研地产化品种为参比制剂。
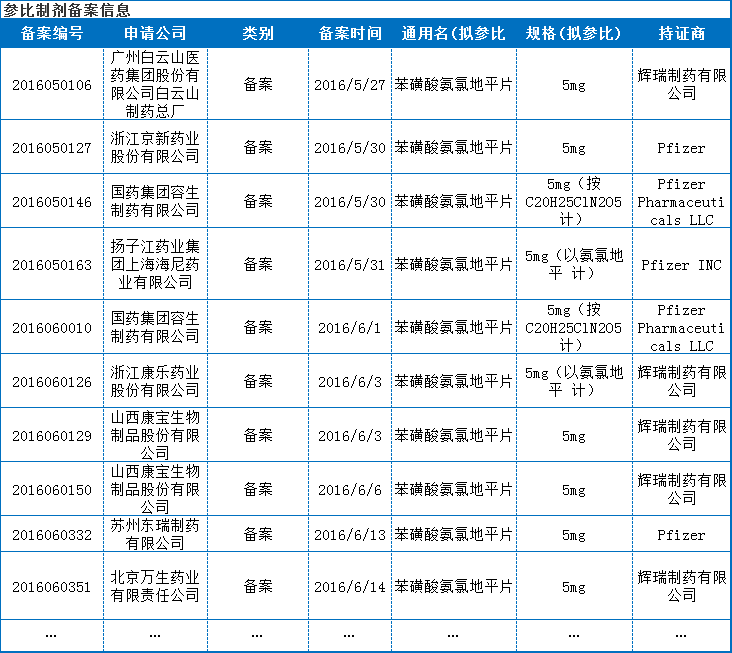
其次是参比制剂备案情况,通过查询药智数据参比制剂备案数据库(主要是收录中检院公布的5953条参比制剂),共有来自46家企业的76条参比制剂备案信息,其中5mg的70条,2.5mg的5条,10mg的1条。
分析这76条数据,除1条选择了日本住友外,其他的均选择了辉瑞制药。其中12条为大连辉瑞(大连辉瑞申报了参比制剂)。可见在这个品种的参比制剂选择上,大家似乎都没有争议;同时也显示出该品种竞争性很大。由于数据太多,只列出备案较早的10家企业。
BE试验信息
国家药物临床试验登记与信息公示平台当前登记的苯磺酸氨氯地平片一致性评价相关的临床试验共71项,其中57项已经完成。
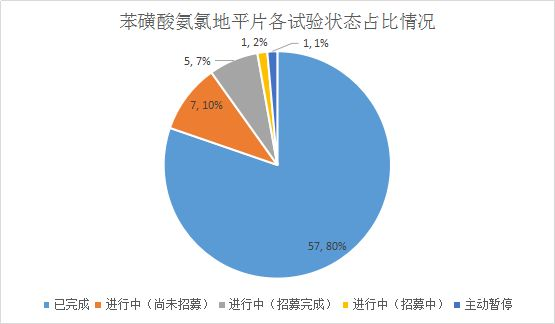
71项临床试验中,属于化学药BE试验备案的57项,其中与一致性评价有关的BE试验共计51个,共计42家企业开展一致性评价BE试验。由于数量较多,此处展示开展时间较早的10个BE试验。

CDE受理信息
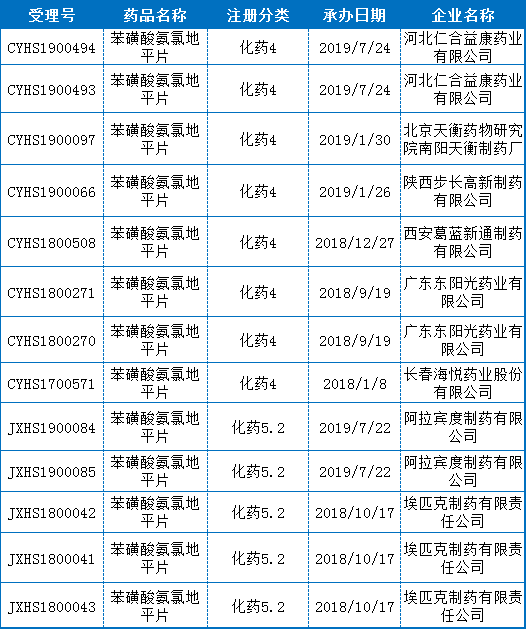
苯磺酸氨氯地平片目前是一致性评价受理最多的品种,受理号达41个。申报企业数为36家,除诺华外,其余均为国内企业,竞争比较激烈。最早的是2017年10月9日获得承办的江苏黄河药业股份有限公司,其次是2017年11月10日获得承办的扬子江药业集团上海海尼药业有限公司。
另外,还有8个受理号按照化药新注册分类的4类和5.2类进行申报,如果获批将视同通过一致性评价。
通过一致性评情况
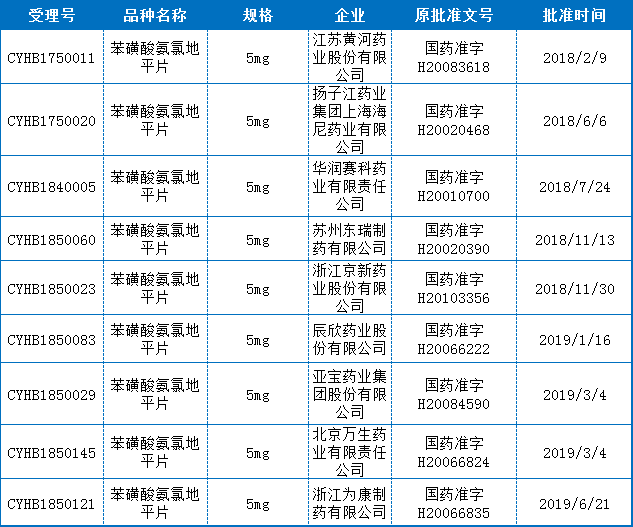
截止目前共有9个企业的苯磺酸氨氯地平片通过一致性评价,规格均为289目录规定的5mg,最早通过的是江苏黄河药业股份有限公司,最近一个通过的是浙江为康制药有限公司。
综上,苯磺酸氨氯地平片目前一致性评价竞争激烈,而且企业不仅要看到原研产品和正在开展一致性评价的品种,按照化药新注册分类申报的品种也需要注意,谨防弯道超车。如果只想看进度情况,这里推荐使用药智数据一致性评价进度数据库。


• 苯磺酸氨氯地平片一致性评价最新进度分析
• 仿制药一致性评价最新进展:受理号达1289个,通过308个
• 2019年国内临床试验年中报告,一致性评价BE试验占19%
• 盘点:2019上半年中国药企获FDA批准的ANDA再添47个,同比增加30.56%
• 一致性评价最新进展:受理号达1197个,通过216个,视同通过77个
• 【独家】一致性评价最新进展:受理号达1117个,通过200个,视同通过67个
• 【独家】2019中国药企ANDA已添23个,昔日霸主华海毫无斩获,各企业赴美热情降低?
• 【独家】一致性评价最新进展:受理号达1051个,通过183个,视同通过65个
• 【独家】2018国内临床试验登记年终报告,一致性评价BE试验占比30%
• 【独家】100个ANDA,24家药企,2018年中国制药国际化道路再创佳绩
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





