【独家】100个ANDA,24家药企,2018年中国制药国际化道路再创佳绩
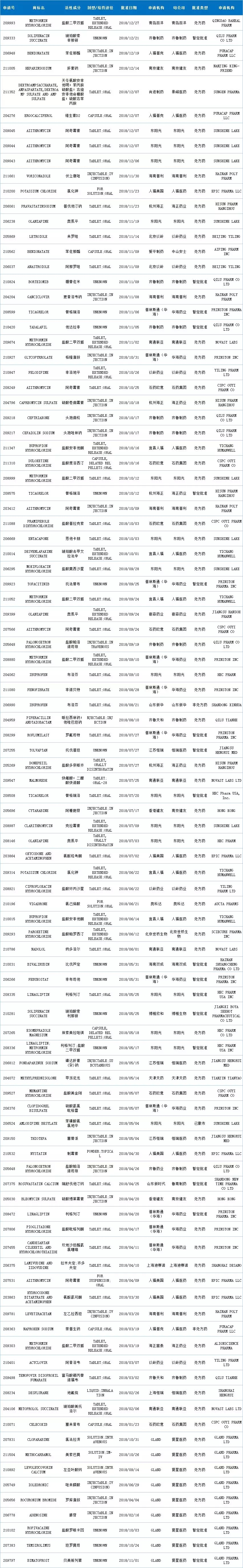
2018年,中国药企获得FDA批准的ANDA再创佳绩,达100个申请号,同比增长122.22%。共计78个活性成分,来自24家中国药企(100个申请号详情见文末图表)。
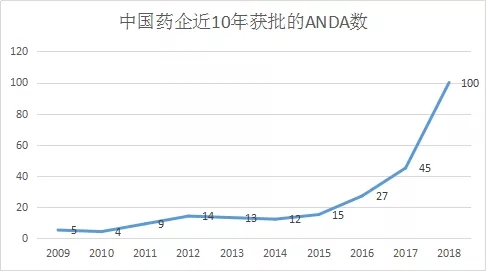
2018年FDA共批准仿制药(Original Abbreviated New Drug Approvals(ANDAs))817个,暂定批准(TentativeApprovals)184个。而中国药企获批的仿制药和暂定批准分别是80个和20个,大约占了10%,也是值得高兴的一件事。不过再看新药,那就没有中国药企的影子了。

2018年批准的100个申请号市场状态如下:处方药77个,暂定批准20个,非处方药2个,已撤市1个。FDA的暂时批准意味着:由于专利权和/或独占权(exclusivity)的原因无法在美国上市,但它符合用于在美国上市的FDA质量、安全和有效性标准。
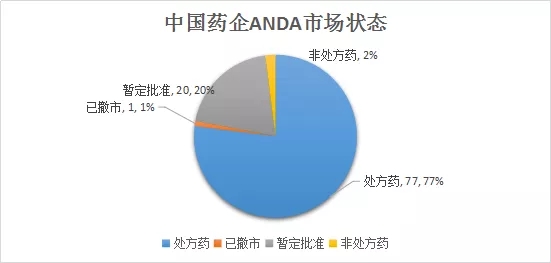
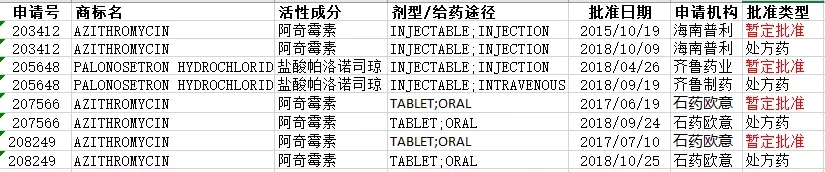
特别说明一下,部分品种最初获得FDA的暂定批准,后由于专利权和/或独占权符合要求正式获得批准。如齐鲁药业的盐酸帕洛诺司琼在2018年4月26日获得暂定批准,后在9月19日正式批准为处方药。因此这部分数据在统计时保留了其批准的历程。
企业方面,2018年ANDA获批情况乐观,24家中国药企有产品入围。一些国际化先行企业依然在列,如华海、人福、齐鲁等企业;可喜的是,2018年还出现了一些新鲜面孔,如以岭、天津天药、博雅欣和等企业。
东阳光2018年表现特别亮眼,上半年获批4个,下半年获批11个之多,总计15个,荣获ANDA批准数量榜首,其中3个为暂定批准。人福医药凭借其美国子公司和国内宜昌人福也收获了13个受理号。华海药业今年虽收获11个申请号,2018年的国际化道路却是几经波折,收到FDA的警告信。但是,2018年5月23日,浙江华海药业的缬沙坦在国内获得批准上市,该品种是凭借“美国上市但未在中国上市、使用境外数据申报、按照新4类仿制药审批视同通过一致性评价”等政策红利完成弯道超车的口服固体制剂。

复星医药通过收购印度药企GLAND,获得了9个申请号。早前复星医药也花费1800万美元从诺华Sandoz收购了123个申请号。如今国内像复星这样多金的药企很多,通过资本的手段拓宽自己的国际化道路也是不错的选择。
总的来说,2018年获批的ANDA创了历史新高,加之中美双报的红利越发明显,中国药企赴美的热情或将持续。本文分析得比较粗浅,主要是给大家提供一个数据,更多信息可访问药智美国FDA数据库。
数据来源:药智数据
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

• 苯磺酸氨氯地平片一致性评价最新进度分析
• 仿制药一致性评价最新进展:受理号达1289个,通过308个
• 2019年国内临床试验年中报告,一致性评价BE试验占19%
• 盘点:2019上半年中国药企获FDA批准的ANDA再添47个,同比增加30.56%
• 一致性评价最新进展:受理号达1197个,通过216个,视同通过77个
• 【独家】一致性评价最新进展:受理号达1117个,通过200个,视同通过67个
• 【独家】2019中国药企ANDA已添23个,昔日霸主华海毫无斩获,各企业赴美热情降低?
• 【独家】一致性评价最新进展:受理号达1051个,通过183个,视同通过65个
• 【独家】2018国内临床试验登记年终报告,一致性评价BE试验占比30%
• 【独家】100个ANDA,24家药企,2018年中国制药国际化道路再创佳绩
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





