美国仿制药中专利挑战的商业策略(之二)
三.挑战专利的程序和司法结构
1. 橙皮书专利登记制度(专利争议界线的划定)
1984年仿制药立法改革之前,FDA在药物申请,审查过程中并不关注药物的专利争议。 所有的专利争议由当事人去专利局和法院解决。由于Hatch-Waxman法案中建立了所谓的“FDA与PTO衔接制度”,为了明确仿制药对专利药的侵权责任,要求专利药向FDA报告NDA的专利状况。FDA将有关专利动态的登记在橙皮书,公示药物的专利和数据独占状态。FDA依据橙皮书专利状态和数据独占,审查、批准相应的仿制药。如果专利药不提交专利信息,FDA视为无专利争议(即FDA可以批准ANDA)。FDA只负责专利登记,不对专利内容和/或法律承担负责。
FDA要求NDA登记的专利包括:
化合物(活性成分)专利
制剂/配方专利
方法/用途专利
*活性物的不同晶型Different polymorphs that are the “same” (dissolution, solubility,bioavailability) as brand (37)
可以不提交的专利:
制备方法,中间体,盐,酯,水合物,溶剂化物,异构体,结晶体等等。
由于建立了专利登记制度,使得处置药物专利争议的程序,相对1984年之前更加明了、规范。过去仿制药为避免侵权,要花费大量的时间做专利检索。而且检索结果的正确性,准确性和全面性往往引起专利争议,或者使争议复杂化。在专利登记制度下,仿制药规避或挑战专利都有了明确、直接的标的。专利药通过专利登记,可以利用FDA法规的前置阻止功能,合理合法地将仿制药的“前置侵权”阻止与市场之外。仿制药通过专利登记可以更加明确地设计仿制策略,规避专利,挑战专利。FDA负责专利登记,每月更新一次。
2. 仿制药申请(ANDA)和专利状态证明(挑战资格的确定)
仿制药在提交ANDA时,要对相应标的药物(Reference Listed Drug RLD)在橙皮书中所列所有专利做出专利状态说明。专利状态分为四类:
Paragraph I: 没有专利列出;
Paragraph II: 有专利,但是已经过期;
Paragraph III: 有专利,但是本申请不寻求在专利有效期内上市(Tentative Approval );
Paragraph IV: 所登记专利为无效专利,或本申请没有侵权。
提交I或II,即为无专利争议。提交III,FDA可以给予“临时批准”,在专利到期后即可上市。提交IV证明即视为“侵权”。
3.专利挑战中的信息对称
仿制药申请人在提交ANDA和PIV证明后,一旦收到FDA的确认信(acknowledgement letter),即为获得了挑战资格。在20天内,ANDA申请人要正式通知(Notice Letter)专利权人或NDA持有人。如果是由于“不侵权”,而不是控对方专利无效,除了陈述不侵权理由外,还要通知FDA赋予专利权人查看ANDA申请文件的权利。专利权人或NDA持有人在接到“侵权”通知后45天内决定是否起诉。如果起诉,通知FDA,FDA依法自动停止对该ANDA审查30个月(ANDA30个月遏制期),如果不起诉(45天不回复),FDA即可启动ANDA审查,批准ANDA上市。在这30个月遏制期内,仿制药赢得诉讼,或者和解,FDA即可启动ANDA审核;仿制药败诉,停止审核到专利期结束。 30个月遏制期结束,专利诉讼没有结束,FDA也可以批准ANDA上市。
4. 挑战专利的流程和法律构架
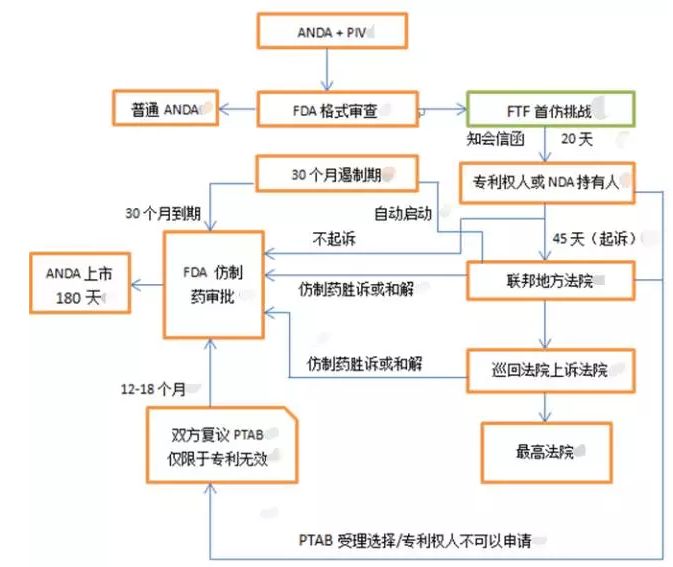
图1. 挑战专利的流程
资料来源:作者自制 2017
注:由于版面的原因,上面的流程只描述了仿制药挑战的“胜利之路”,省略了“败诉”之后的路径。在整个流程中,一旦败诉,仿制药就归于“普通ANDA”,或等待专利到期FDA审查上市。
专利诉讼的法律构架:
机构设置:FDA,USPTO,FTC,ITC,地方法院/上诉法院,最高法院,国会。
法规分为三个层次:
国会法案(例如:《联邦食品、药品和化妆品法案》,《Hatch-Waxman Act》);
联邦法规集(例如:21CFR(制药部分),35CFR(专利部分));
FDA的MMAPs 和Guidance。
我对三个层次的理解是:国会法案定规矩;联邦法规集对这些规矩做出定义;MMAP和指导意见(不负法律义务)分别描述FDA怎么做,ANDA怎么做。凡是药物专利争议中涉及到上述法律的问题,均可做专利诉讼。美国没有专利法院,专利无效或专利侵权由美国地方法院裁决。不服地方法院的裁决,可以上诉至华盛顿DC巡回法院的上诉法院(CDFC)。上诉法院的裁决一般为终裁。只有上诉法院可以提交最高法院裁决。这就是所谓美国诉讼的“单通道”原则。 最高法院可以提交国会,国会修改法律解决问题。 美国联邦贸易委员会(FTC)是美国国会下设的执法监督机构,也有相应的立法权。该委员会直接向美国国会报告并负责,有点像我们的“发改委”。所以美国FDA和美国专利局都让他三分。FTC下设的国际贸易委员ITC可以直接通知美国海关扣押进入美国的货物,例如,药品,化学原料,然后直接向上诉法院提起专利诉讼。就是说,ITC可以一步把官司打到“终裁”!美国制药商经常利用这一优势打击国外对手。
5. 美国专利复审委员会(PTAB)双方复议- IPR
上一节介绍了美国专利诉讼的“单通道”,那是个漫长而花钱的旅程。往往一个专利案子一搞就是3年,5年。 光律师费,诉讼费就会把实力不济的小企业搞垮。 2012年美国通过了《美国发明法》(America Invention Act, AIA),推出处理专利争议的“双方复议”Inter Parte Review IPR制度。这个制度的特点是: 时间快(一年结案,最长18个月);费用低(大约50万-100万美元);专业判案:由专利复审委员会(Patent Trial and Appeal Board,PTAB)判案;判决结果在上诉法院之下是终裁。就是说,凡是IPR的结论具有不可复议性(estoppel),地方法院和其他执法机构不得重议。如果不服判决,上诉至上诉法院。IPR只接受专利无效案(不解决专利侵权诉讼),起诉者必须是专权人或NDA持有人之外的第三方(专利药持有人不能到IPR起诉)。一旦IPR开启,地方法院一般会休庭,等待IPR的裁决结果。如果你认为有足够的证据可以无效掉对手的专利(创造性,新颖性,专利性),而又想节约时间,尽快结案,同时省下巨额律师费和诉讼费,走IPR是个很好的选择。与地方法院不同的是,IPR不是所有诉讼都接受,它是定期开庭制,事先要筛选申请,受理与否由PTAB决定。
6. 180天的获得和失去
专利权人不起诉,和解,或挑战者胜诉的,FDA批准上市ANDA的首仿获得180天仿制药销售独占权。在此180天内FDA不批准其他相同的ANDA上市。
但是,下述情况下180天作废:
1)FDA批准ANDA后75天、法院判决后75天、仿制药没有销售,180天作废;
2)ANDA申请至30个月,如果没销售,180天作废;
3)FTC和司法部认为违反反垄断法的和解,180天作废;
4)ANDA修改或撤回PIV证明,180天作废;
5)期间所有橙皮书登记专利到期,180天作废;
6)后续ANDA挑战专利成功75天后,第一个挑战者没销售,180天作废。
以上简单的介绍了美国专利挑战的立法历史和专利挑战的基本过程。
四.换角度看药物专利
美国专利与商标局的大厅篆刻着林肯总统的名言:“专利制度是给天才之火浇上利益之油”。这是现代人创造专利制度的初衷,而且专利制度在人类技术进步中所起的作用毋庸置疑。但是,如果你把仿制药挑战专利当作一种商业策略的话,就应该换一个角度去审视药物专利。
专利证书不是“科学证书”
专利是政府授予发明人的一种有限权利。这仅仅是一种权利,与发明本身的技术水平,实用价值无关,更与“先进”或“科学”无关。所谓“自主知识产权”仅指对某个知识产品拥有权利,而不是说你这个知识产品就一定先进的,科学的,有价值的。政府授予专利的目的是换取发明人公开发明内容,申请人申请专利更多的是一种商业手段。
2.专利证书是流水线作业的产物
从专利的具体产生过程来看也是如此。首先,专利审查员只是审查“专利申请书”,而不需要“验证”或“证实”专利申请是否真实,是否可行,是否有价值。即便是“虚假专利”也不构成犯罪(后文将会讲到虚拟专利的合法性问题)。甚至可以说的极端一点,专利申请书只需要“写”,而不要求必须“做”。审查员授予专利权的根据仅包括,但不限于:专利申请书,审查员的检索结果,和审查员本人的认知。
如果我们质疑:
专利申请不实,或瑕疵,或抄袭呢?
审查员的检索如果有遗漏呢?
审查员的认知就一定对吗?合理吗?
美国每年有大约30万份专利申请,其中和药物有关的约为6万份,专利审查员总数不过4000人。有学者统计:每个专利审查员花在一个专利的平均时间为20-30个小时。从逻辑上来讲,这么短的时间内,完成一个专利的几项、十几项、甚至几十项权利要求的检索,审查,评估,实在是不现实。
3.药物专利的特殊性【3,4,5】
1)药物专利的“为专利而专利”
美国的政治学人调侃制药业:美国制药商只会通过专利赚钱,所以他们不会生产没有专利的药物。因为天然存在的不授予专利,为了获得专利就必须做自然界不存在的物质,所以自然界存在的物质就不可能成为药物。说是调侃,细想之,难道制药业的现状不是如此吗?我们都知道,几乎没有药物制造商不利用“常青专利”(Evergreening patent,美国的法官称之为“frivolous patent - 无聊专利,也可以译为:无赖专利”)延长专利的独占时间。按照美国“反不正当竞争法”,所有的常青专利都是违法的。所以,如果你(你雇佣的律师)能使法官相信,你挑战的专利是“Evergreening Patent”,那么你就有了胜算。
2)药物专利的价值依附于“高,福,帅”的NDA
如果专利与FDA批准上市的“药物”(NDA)无关,那么它就是堆积在专利局仓库或储存在专利局硬盘中的“垃圾专利”,其中绝大多数毫无价值可言。一旦NDA获的FDA批准,成为上市药物,附着与该NDA的专利马上“乌鸡变凤凰”,在专利诉讼中,可以要到天价。但是专利的质量并没有因为FDA批准NDA上市而改变,专利原有的瑕疵没有因为FDA批准了NDA而得到纠正。专利价值的改变仅仅由于专利附着物变成了“药物”而发生改变。细想一下,申请一个专利,慢也就3,4年,花费不过几万美元;申请一个NDA要花费10-15年,要花几十个亿美元。而几个万把美元的专利却保护着几十亿、甚至百亿的市场价值!美国专利局批个专利多容易?FDA批个NDA有多难?那有什么理由不去挑战这些专利的真实性、合理性和合法性呢?
3)FDA的法规赋予药物专利阻止“侵权行为”发生功能
对普通专利而言,专利本身不能阻止“侵权”行为发生。你可以在侵权行为发生后,提起诉讼,阻止侵权,追溯侵权损失。 但是,药物专利一旦登记在FDA的橙皮书,FDA就不会审核可能出现专利争议的ANDA。这样专利本身就起到了阻止“侵权”的功能。
4)PIV证明的“前置侵权假设”(after fact/prior to fact)
一般的专利侵权诉讼中,专利法赋予专利权人在专利侵权发生后(after fact)要求赔偿的权力。而按照FDA专利挑战法规,ANDA向FDA提交PIV证明,即视为“侵权”(prior to fact)。随后产生专利诉讼,30个月的滞止期等等,都是在实际侵权行为并没有发生的情况下进行的,是以“前置假设”进行的。从仿制药的角度,挑战专利就是对“前置假设侵权”的一种申诉和反抗。
5) 被告胜诉还可以与原告共享有限市场独占权
普通的专利诉讼,作为被告的侵权人胜诉,一般是免于赔付,继续侵权行为而已。但是在专利挑战中,被告的侵权人胜诉,还可以与原告共享180天的有限市场独占权。
6) FDA和美国专利(PTO)衔接中的“不衔接”
理论上1984年的Hatch-Waxman 法案制定了FDA和PTO的专利衔接规则。FDA和PTO之间应该对每一个NDA申请和橙皮书的专利登记做到准确无误的无缝衔接。例如,PTO的专利延期(PTE),每个产品只能有一个专利延期,只能是涉及发明产品的权利要求延期,延期后60天内要通知FDA等等,很多彼此的衔接细节。但是FDA和PTO是美国两个巨大的官方机构,每年几万件专利申请,几千件药物申请,衔接中的不衔接也属于正常。如果你的律师能找出衔接上的瑕疵,说不定就可以“四两拔千斤”。相信大多数人的判断,FDA和PTO在他们的“衔接”过程中一定有很多“不衔接”。
五. 专利概念和技巧举例
创造性,新颖性,专利性
创造性 Non-Obviousness(把Non-Obviousness 翻译为“创造性”是不是合适?):
这是无效掉专利的常用手段之一。英文的字面意思大家都很熟悉:Non-Obviousness 非显而易见。显而易见是指:本领域普通技术人员可能想到,可能做到,反之,就是“非显而易见”。在药物专利创造性争议中最多见的就是同系物,异构体,代谢物,酯,盐,水合物,溶剂化物以及药物制剂的难度等等。这些东西属于“显而易见”还是“非显而易见”,经常是法庭争论的主题。在专利争议诉讼中,有关“显而易见”性的判断既复杂,又简单。没有固定的、严格的标准。所以律师的辩护水平,法官的个人倾向和逻辑都会造成诉讼结果的差异。
新颖性(Novelty):
在专利申请前不能公开你的发明内容,公开了就失去了新颖性。美国专利法里有个“Grace Period”,发明人提交专利申请前一年内,在一定的条件下公开或部分公开发明内容不失去了“新颖性”。但是,与发明人有直接利益相关的第三人公开内容不是来自于发明人本人,或公开内容与原发明相比有所改变,则失去新颖性。在美国境外公开失去新颖性。
2011年,TEVA在提交专利之前将专利化合物送到某个检测机构做检测,传递过程没有签署保密协议,检测过程也没有保密协议。最后对方律师声称检测人员为本领域技术人员,通过检测可以掌握发明内容,故该专利已经失去新颖性,法院判TEVA专利无效(Martin Voet 2014)。
专利性(Patentability):
天然存在的物质不具专利性,那么代谢物算不算天然存在?异构体的分离和拆分有没有专利性?
创造性,新颖性和专利性是针对化合物专利做专利无效的三个主要手段。
2. 虚拟专利(Reduction to Practice)
由于专利的审查和授权完全依赖于对专利申请书的审查。而专利法并不要求专利申请书“以事实为依据”。所以,即便是完全由想象完成的专利申请,即所谓“设计”专利也完全有可能获得批准,从而获得专利权。这在专利上叫做“reduction to practice ”。如果审查员对发明真实性怀疑,可以要求申请人提供证据,发明人不提供证据仅可能失去专利权,而不会构成“欺骗罪”。就是说,专利申请人不对专利的真实性承担法律责任。
3. 发明人制度Invention-ship
美国专利制度规定,发明人必须是个人,不可以是一个组织,一个企业。如果挑战者能找出发明人的漏洞,例如,发明人登记错误,也可以导致专利无效。因为大多数药物专利是企业提交,发明人与企业签有受让协议,故发明人的登记有时候就不那么较真,所以误登,错登时有发生。
4. 重复专利和专利终结 (Double Patenting and Terminal Disclaimer)
在专利申请中,重复专利(Doubling Patent)会导致专利无效。重复专利是指:一项发明在多个专利中申请权利。但是,在药物研发过程中,尤其是专利药在制造“evergreening patents”时,对于新增专利的专利要求的范围很难做到与前有专利“严丝合缝”。发明的衔接,专利的申请,尤其是前后两个专利的权利要求书经常会出现内容的重叠。但是权利要求不能重叠,哪怕是一点点的重叠,都可能是“重复专利”。前一个专利没有到期,后续专利权利要求如果无法回避权利重叠,必须要终结前一专利,才能申请后续专利。这个终结声明叫做“Terminal Disclaimer”。如果没有做,或者时间做的不对,内容不对,都有可能造成专利无效。
5. 用途专利:小8条(Section Viii)声明
1984年Hatch-Waxman 法案规定,仿制药的使用标示必须与原创药的使用标示一致。另外,仿制药在向FDA提交申请时,必须对橙皮书所列专利一一做出状态声明。专利药为了阻止或延迟仿制药竞争,逐步登记新用途专利,不断制造PIV挑战,不断产生新的30个月滞止期,以此阻止或延迟仿制药进入。2003年,美国巡回法院审理了Warner-Lambert V.Apotex (Fed. Cir. 2003)侵权诉讼案,做出有利于仿制药的判决,出台了FDCA 505(j)(2)(A)(viii)新法规。对原来Hatch-Waxman 法案中要求仿制药的使用标签与原创药一致的规定做了修改:ANDA可以提出请求(Section Viii Statement), 要求FDA在使用说明书中删除处于专利保护状态的用途(patent use code),保留非专利用途(这就是小8条的由来)。最高法院2012年对Caraco v.Novo Nordisk (Supreme Court 2012)的判决,不但更加明确和强化了Section Viii ANDA的合法地位,另外给予仿制药在专利诉讼状态下质疑或要求FDA修改或撤消橙皮书登记专利的“反诉权”。小8条ANDA不涉及专利侵权,没有30个月滞止期,也不会得到180天独占权,一经FDA批准即可上市(在专利期内上市),由此引起的争议到法院解决。 小8条是仿制药公司经常使用的申请策略,其优点是ANDA不需要提交PIV证明,理论上不需要专利诉讼,尽管没有180天独占,但上市时间可以大大提前。但是小8条申请受理与否,裁决权在于FDA。
6. 查专利审查卷宗,找出专利权人放弃的权利
按照美国专利法,在专利申请,审查过程中,专利权人或专利代理人,或专利律师放弃了的权利均不能出现在授权专利要求中。那么,仿制药挑战者的专利律师就要认真查阅专利审查卷宗,看看有没有对方放弃的东西又出现在专利中,如果有,那就是专利无效(这叫做-Estoppel)。为什么会出现这种情况呢?因为在专利提交时,一般专利要求的范围都会比较宽,经过与专利审查员的讨价还加,逐步缩小范围,直至授权。有时候,这些放弃的内容,会出现在专利人的起诉中。
7. 去查PGR和/或IPR记录,看有没有“禁反言”纪录Estoppel
PGR的意思是“授权后复审”,即在专利授权后9个月内,任何人都可以对专利授权提出异议。由专利复审委员会(PTAB)给予答复。这一答复在上诉法院之下的机构,是不可以复议的Estoppel。
8.“诉讼确认”- Declaratory Judgement Action
按照专利挑战规则,专利权人或NDA持有人在收到挑战者“Notice Letter”45天内要决定是否起诉。如果不起诉,FDA即可批准ANDA。但是,ANDA上市后,专利权人可以起诉侵权,ANDA败诉,还是要赔付对方由于侵权带来的经济损失。2003年MMA法案规定:如果45天内专利权人不回复专利挑战,仿制药申请人可以向法院提起“诉讼确认”-Declaratory Judgement Action,要求专利权人或NDA持有人确认侵权与否,要么起诉,要么确认没有侵权。凡经过“诉讼确认”,专利权人就丧失了日后的起诉权利。
9. 反诉权- Counterclaim
反诉权,是指被告在诉讼期间有权要求法庭针对不利于被告的某些证据做出修改或更正的权利。例如,仿制药要求FDA修改橙皮书专利,或要求去掉橙皮书中的专利(De-listing)等等。反诉权,只有被告可以获得。
这里所谈到的只是专利诉讼所涉及的很小一部分专利概念和解释,仅做抛砖引玉之用。他们是属于专利律师的工作。
参考文献:
【1】<The Generic Challenge> Martin Voet 2014
【2】ANDA Litigation Basics Under the Hatch-Waxman Act and Medicare Prescription Drug, Improvement and Modernization Act of 2003 Posted on Nov 16, 2015
【3】For Most Small Companies Patents Are Just About Worthless Forbes 2013/10/04
【4】Most Patents are Worthless: Here is Why – IP Asset Maximizer Blog, Apr. 17, 2009
【5】The Private Value of Entry and Deterrence in the U.S. Pharmaceutical Industry Ruben Jacobo – Rubio et al ., January 11, 2014



合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



