从全球抗肿瘤药销售10强看国内申报 700亿超级市场将花落谁家?
据药智数据统计,2000-2016年美国在研新药申请数量(按治疗领域分类)排名第一是抗肿瘤类药物。随着环境污染的加重,肿瘤人数近20年来快速激增,与之对应带来的是广阔的抗肿瘤药物市场。据IMS数据显示,2014年全球抗肿瘤药物市场累计销售额超过600亿美元,2015年高达632.2亿美元,同比增长5.3%。从以下数据可以看到,目前在抗肿瘤领域占据头把交椅的当属罗氏,利妥昔单抗注射液、贝伐珠单抗、注射用曲妥珠单抗三大王牌产品连续5年分别蝉联冠、亚、季军,仅抗肿瘤这一大领域,5年时间创造了831.3亿美元的销售神话,分食了2011-2015年全球抗肿瘤药物30%的市场,而且这个数据还处在不断增长的趋势中。相比罗氏,诺华公司的实力也不容小觑,其三大产品角逐市场的实力不断增强,对罗氏而言也是一大劲敌。不难看出,爆发式增长的数据显示,抗肿瘤市场是一块不断增大的超级蛋糕,人人都想分一杯羹。让我们一起观战国内市场,哪些企业开始在紧随其后,加紧步伐开始仿制创新,力争在这个领域打出一片天地?
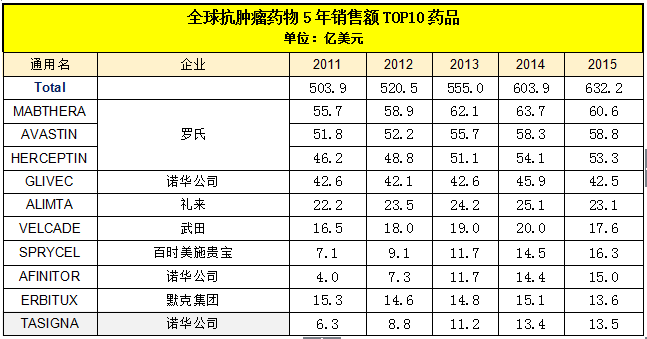
数据来源:IMS数据库
1.利妥昔单抗注射液(MABTHERA):

利妥昔单抗为罗氏公司超级重磅产品,1997年在美获批上市,2000年获批进入中国,为近五年全球最畅销的抗肿瘤药物。
本品适应症为:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗;先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤,患者应与标准CVP化疗(环磷酰胺、长春新碱和强的松)8个周期联合治疗;CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
国内申报状况:利妥昔单抗仅注射液一剂型。从2012年截止迄今,国内共计36个药品【按受理号计,下同】注册申报(补充申请25个、进口9个、新药2个),其中2个批准、8个批准补充、4个不批准、2个终止审批程序、7个批准临床。就申报的企业来看,目前国内有正大天晴、华兰基因工程有限公司企业申报该新药,并分别于今年9月、11月批准进入临床。与此同时,印度瑞迪博士实验室有限公司两个进口药品正在进行临床试验申请,目前排序100多位。
注册申报的两个新药被批准进入临床
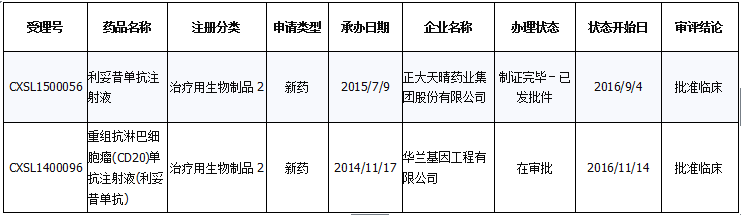
数据来源:药智数据
2.贝伐珠单抗(AVASTIN):
贝伐珠单抗是一种单克隆抗体药物,由罗氏和其他企业合作开发的一大明星产品。2004年,该药品在国外获批用于非小细胞肺癌的治疗,2015年年中被CFDA批准用于用于晚期、转移性或复发性非鳞非小细胞肺癌的一线治疗。与此同时,该药品还获得很多新的适应症,如恶性胶质瘤、宫颈癌、卵巢癌、转移性细胞癌等。目前是全球抗肿瘤领域第二畅销的药品,2015年全球销量为58.8亿美元。
适应症:本品适用于转移性结直肠癌贝伐珠单抗联合以5-氟尿嘧啶为基础的化疗适用于转移性结直肠癌患者的治疗。
国内申报状况:贝伐珠单抗仅注射液一剂型。目前国内注册申报有25个(补充申请16个、进口6个、新药3个),其中终止审评程序1个、批准补充4个、批准临床4个。值得一提是,注册申报3个新药均为治疗用生物制品2,恒瑞2个,一个终止审评程序,另一个2016年8月批准临床;正大天晴1个,2016年9月底批准进入临床。
注册申报的3个新药概况

数据来源:药智数据
3.注射用曲妥珠单抗(HERCEPTIN):
曲妥珠单抗,蝉联近五年全球抗肿瘤药品销售季军,1998年在美获批上市,是一种重组DNA衍生的人源化单克隆抗体。作为常用的靶向药物,该药品可以选择性地作用于人表皮生长因子受体(HER2)的细胞外部位,从而阻断癌细胞的生长,并且还可以刺激身体自身的免疫细胞去摧毁癌细胞。研究发现,曲妥珠单抗对心脏有一定的损害,主要为收缩蛋白水平上改变,患者可能会出现一系列的心脏不适。
适应症:本品适用于HER2过度表达的转移性乳腺癌:作为单一药物治疗已接受过1个或多个化疗方案的转移性乳腺癌;与紫杉醇或者多西他赛联合,用于未接受化疗的转移性乳腺癌患者;本品单药适用于接受了手术、含蒽环类抗生素辅助化疗和放疗(如果适用)后的HER2过度表达乳腺癌的辅助治疗。
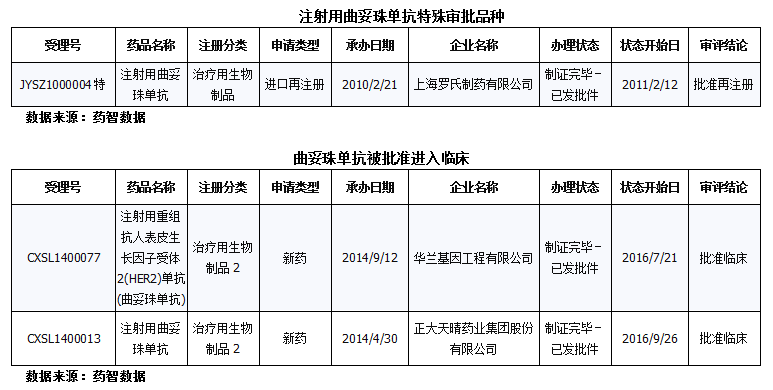
国内申报状况:注射用曲妥珠单抗国内仅粉针一个剂型,迄今为止注册申报共计47个(补充申请29个、进口10个、进口再注册5个、新药3个),其中不批准1个、批准补充14个、批准再注册3个、终止审批程序1个、批准临床5个。在近50个注册申报的药品中,上海罗氏的该药品为特殊审批品种,目前被批准再注册。华兰基因工程有限公司及正大天晴的治疗用生物制品2新药,分别于今年的7月和9月批准进入临床。
4.甲磺酸伊马替尼片(GLIVEC):
甲磺酸伊马替尼为诺华公司一大拳头产品,2001年在美问世,是第一个被美国FDA批准上市的酪氨酸激酶抑制剂(TKI)。该药品有两大剂型,片剂规格有100/400mg;囊剂型有50/100mg。可用于慢性髓性白血病(CML)、胃肠道间质肿瘤(GIST)、急性淋巴细胞白血病和黑色素瘤的治疗。在欧美日等国,甲磺酸伊马替尼被列为罕见病用药物,地位极高。
适应症:用于治疗慢性粒细胞白血病(CML)急变期、加速期或α-干扰素治疗失败后的慢性期患者;不能手术切除或发生转移的恶性胃肠道间质肿瘤(GIST)患者。
国内申报状况:甲磺酸伊马替尼有两大剂型:片剂和胶囊剂。
截止目前,甲磺酸伊马替尼片剂注册申报共计75个(补充申请24个、仿制35个、进口13个、进口再注册3个),其中不批准2个、批准补充12个、批准进口8个、批准临床31个、批准生产2个、批准再注册2个、企业撤回4个、终止审批程序1个。值得一提的是,75个注册申报的药品中,有2个为重大专项,江苏豪森已批准生产,先申报的石药集团也于2013年初批准进入临床。
片剂中,2大重大专项品种情况一览

数据来源:药智数据
从2001年迄今,甲磺酸伊马替尼胶囊剂注册申报共计30个(新药2个、进口3个、进口再注册3个、仿制13个、补充申请9个),其中批准2个、不批准1个、批准临床11个、批准再注册2个、企业撤回2个、批准生产2个、批准补充3个。在批准生产的药品中,正大天晴有2个重大专项品种,为化药6类。
正大天晴有2个重大专项品种

数据来源:药智数据
5.注射用培美曲塞二钠(ALIMTA):
培美曲塞二钠是礼来公司抗肿瘤领域中的一员大将,2004年美国FDA快速审批其联合顺铂联用治疗一种罕见癌症---恶性胸膜间皮瘤,同年8月,该药品被批准用于治疗复发的局部晚期或转移性非小细胞肺癌。2005年,培美曲塞二钠成功打入中国市场。目前除进口外,国内以江苏豪森、齐鲁制药、广州白云山、扬子江药业、南京先声东元等为代表的16家企业已陆续生产上市该仿制药。
适应症:适用于与顺铂联合治疗无法手术的恶性胸膜间皮瘤。
国内申报状况:迄今为止,培美曲塞二钠国内注册申报量高达137个(补充申请54个、仿制25个、复审2个、进口19个、进口再注册2个、新药35个),其中批准临床22个、批准再注册2个、企业撤回2个、批准生产16个、批准补充29个、批准进口7个、不批准8个、退审1个。在注册申报的35个受理号中,有13个被批准进入临床。
13个被批准进入临床的新药
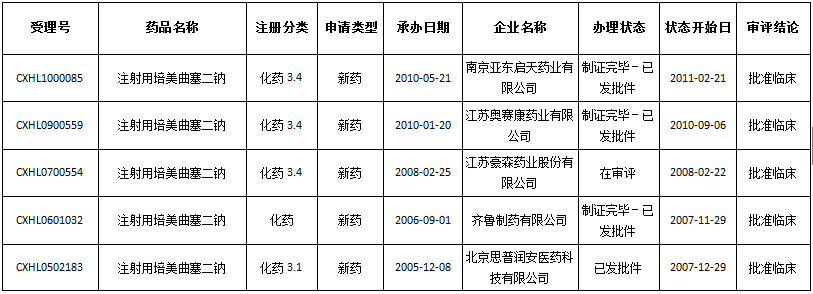
数据来源:药智数据
6.注射用硼替佐米(VELCADE)
硼替佐米为武田公司的一大抗肿瘤明星药物,近五年全球累计销售额近百亿美元,是武田公司唯一一款进入全球抗肿瘤药品销售额top10的药品。
适应症:本品用于多发性骨髓瘤患者的治疗,此患者在使用本品前至少接受过两种治疗,并在最近一次治疗中病情还在进展。
本品用于复发或难治性套细胞淋巴瘤患者的治疗,此患者在使用本品前至少接受过一种治疗。用于该适应症的安全有效性数据来自国外一项针对先前治疗后复发的套细胞淋巴瘤的单臂II期临床研究(见【临床试验】),尚缺乏针对中国人群的临床研究。
国内申报状况:仅粉针一个剂型。目前国内注册申报量为62个(进口9个、仿制28个、补充申请25个),其中不批准1个、批准临床5个、批准补充10个、批准进口1个。
批准进入临床的5个药品
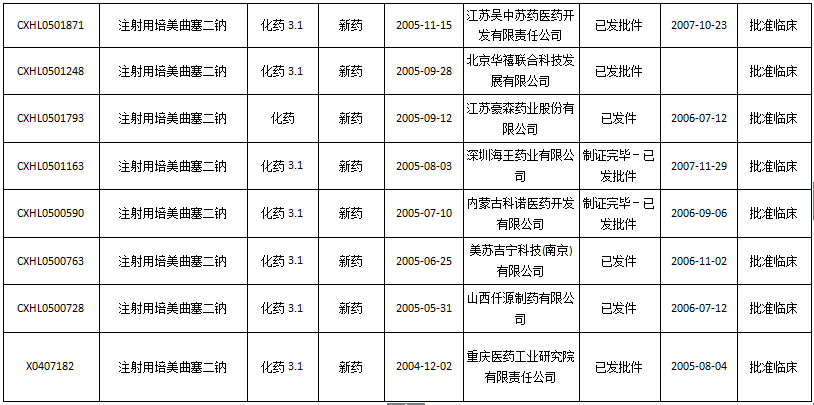
数据来源:药智数据
7.达沙替尼片(SPRYCEL)
百时美施贵宝公司的达沙替尼是一款于2006年上市的新药,2011年迅速打开中国市场,国内进口的规格有20/50/70/100mg。除进口外,正大天晴已经凭借其先发优势和专利规避生产该新药并上市,规格有20/50/70mg,价格仅为原研药的1:8。尽管这两年达沙替尼片的全球销量有小幅上涨,但是从长远来看,市场已被挤占,发展前景有限。
正大天晴已生产该新药
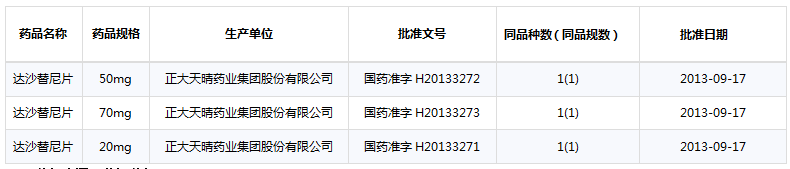
数据来源:药智数据
适应症:本品用于治疗对甲磺酸伊马替尼耐药,或不耐受的费城染色体阳性(Ph+)慢性髓细胞白血病(CML)慢性期、加速期和急变期(急粒变和急淋变)成年患者。
国内申报状况:达沙替尼为片剂,截止目前国内共注册申报86个(新药21个、进口14个、仿制39个、补充申请12个),其中批准临床57个、企业撤回4个、批准生产3个、批准补充4个、批准进口4个。众多注册申报的药品中,正大天晴三个受理号均为重大专项品种,目前已批准获得生产。
正大天晴三个受理号均为重大专项品种
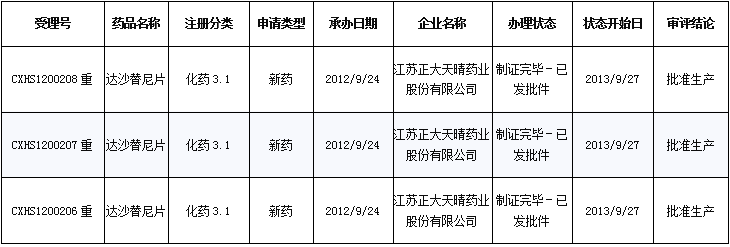
数据来源:药智数据
8.依维莫司片(AFINITOR)
依维莫司由诺华公司生产,是抑制mTOR的西罗莫司的衍生物。依维莫司之前已被FDA批准用来治疗多个肿瘤,包括使用其他方法治疗后进展的晚期肾癌(2009年);胰腺来源的成人进展性晚期神经内分泌肿瘤(2011);结节性硬化症(TSC)患者的不必立即手术的肾血管平滑肌脂肪瘤(2012);联合依西美坦治疗激素受体阳性、HER2阴性晚期乳腺癌患者(2012)。目前,该药品仍在开发其它新的适应症,2013年获准进入中国。
适应症:预防肾移植和心脏移植手术后的排斥反应。
国内申报状况:依维莫司仅片剂,目前国内注册申报量为59个(新药17个、进口26个、仿制6个、补充申请8个、复审2个),其中不批准4个、批准临床27个、批准补充2个、批准进口2个。59个受理号中,北京诺华制药有3个受理号为特大审批品种,其中两个被批准进口。
注册申报的3个特大审批品种
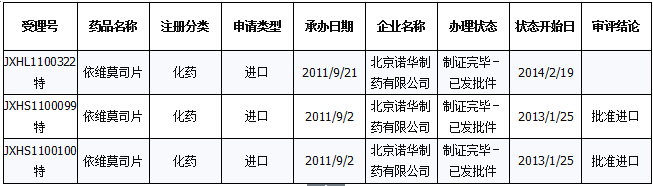
数据来源:药智数据
9.西妥昔单抗(ERBITUX)
西妥昔单抗是默克公司与BMS联合开发的一个新药,2003年年底在瑞士首次上市,是第一个上市的靶向单克隆抗体。2004年FDA批准与放疗联合(一线治疗)或单独使用(在标准治疗后)治疗非转移性头颈癌。2011年起,美国FDA再次批准西妥昔单抗与化疗药物联合用于晚期(转移性)头颈癌患者的治疗。2006年登陆中国。
适应症:本品单用或与伊立替康(irinotecan)联用于表皮生长因子(EGF)受体过度表达的,对以伊立替康为基础的化疗方案耐药的转移性直肠癌的治疗。还适用于转移性头颈癌,非转移性头颈癌,非小细胞肺癌等。
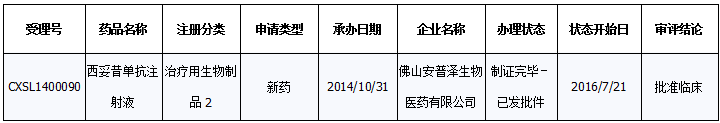
国内申报状况:西妥昔单抗仅注射液一个剂型。目前国内注册申报共计22个(新药1个、进口10个、补充申请11个),其中不批准1个、批准临床9个、批准补充5个、批准进口2个。仅受理的1个新药于2016年7月批准进入临床。
1个新药批准进入临床
数据来源:药智数据
10.尼洛替尼胶囊(TASIGNA)
尼洛替尼为诺华公司研发的第三大抗肿瘤药物,市场规格有150/200mg。2007年被美国FDA批准用于治疗疗慢性粒细胞性白血病或者慢性髓性白血病(CML)。近年来新发现该药品还可改善帕金森病和路易体痴呆患者的认知、运动能力,治疗神经衰退性疾病。2014年初,尼洛替尼被批准进入中国,目前被江苏省纳入医保,为乙类。
适应症:用于对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病(PhCML)慢性期或加速期成人患者。
国内申报状况:尼洛替尼为胶囊剂,目前国内注册申报量为26个(进口7个、仿制6个、补充申请13个),其中批准临床13个、批准补充6个、批准进口2个。
被批准进入临床的9个药品

数据来源:药智数据
从注册申报的品种、参与申报的进度、企业所占的比重中不难发现,参与全球抗肿瘤销售额TOP10药物仿制中,90%以上为国内大型制药企业,以正大天晴、华兰生物、恒瑞、豪森、石药为代表。众多企业争先恐后中,正大天晴火力最猛,10个抗肿瘤药物中参与并进入临床的有5个,均是新药,其中一个已上市,其次积极的是江苏豪森及华兰生物。为了最大限度地抢夺市场,这些大型制药企业可谓煞费苦心,而苦心拼杀的背后正是巨额财富的牵引。当然有好药新药产出,受益的是患者,他们不需要散尽家财也可以有效治疗自己的疾病。对中国制药行业而言,巨额财富的引诱能让行业焕发勃勃生机,走向春天。
注:本文系药智网作者原创,欢迎转载,转载时请注明出处和作者,谢谢!


合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938




