盘点:中国药企业获得FDA批准的ANDA药,石药、恒瑞、齐鲁、人福、药友……
最新:2017年11月20日,力品药业(厦门)有限公司的盐酸可乐定缓释片获FDA批准。
笔者通过药智数据美国FDA药品数据库对中国企业在FDA申报的ANDA药进行了不完全统计。数据显示,中国企业获得FDA批准的ANDA达到331个品规,157个申请号。浙江华海药业和南通联亚(品种相对单一,本文不作重点介绍)FDA申报数量遥遥领先。齐鲁药业、恒瑞药业、人福普克也持续发力,稳步进军美国市场。随着一致性评价的展开,仿制药获得美国或欧盟批准的可加速在我国报批审核的进程。另外,不少企业通过并购美国企业等作为进军海外市场的路径。如人福医药在2016以5.5亿美元收购美国Epic Pharma及附属企业,获得了Epic Pharma拥有的52个仿制药制剂文号(其中16个已撤市)。
以下是各中国企业ANDA获批数量统计,按申请号计(文章最后附中国药企获FDA批准的ANDA药详细表),如果不全,请您在下方留言。

按年统计批准情况显示,FDA申报之路最早可追溯到1974年,人福普克药业可谓先驱者,最早申报了美索巴莫片(已撤市),5年之后的1979年,浙江华海也是通过申报美索巴莫开始了FDA申报之路。随着中国制药行业的发展,FDA批准的中国仿制药也不断增加,2016年达到了23个,其中齐鲁药业在2016年获得了6个ANDA制剂文号,常州制药在2016年首次获得了FDA批准的ANDA制剂。截止目前,2017年已经有23个申请号了,已经与2016年持平。

市场状态方面,处方药占了近83%的比例,也有13%的药品已经撤市了。值得一提的是由于专利权等原因,有6个药品获得的临时批准。
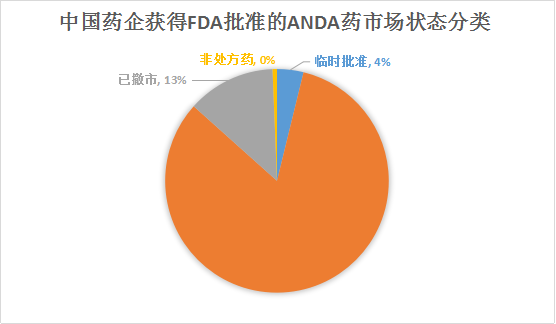
总体来说,中国药企业的国际化道路正稳步前进。近年来,很多企业也获得了FDA的临床试验批准,希望中国药企能有真正NDA药上市。分析得比较粗浅,本次主要是给大家提供一个数据。更多信息可访问药智数据美国FDA数据库,我们将在近期增加中国药企的检索项,敬请关注。
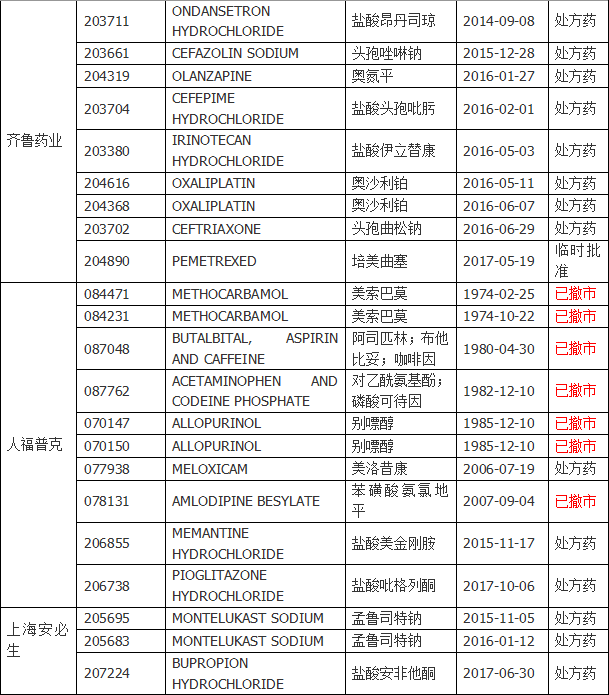
附件:各企业FDA批准药品详表












• 苯磺酸氨氯地平片一致性评价最新进度分析
• 仿制药一致性评价最新进展:受理号达1289个,通过308个
• 2019年国内临床试验年中报告,一致性评价BE试验占19%
• 盘点:2019上半年中国药企获FDA批准的ANDA再添47个,同比增加30.56%
• 一致性评价最新进展:受理号达1197个,通过216个,视同通过77个
• 【独家】一致性评价最新进展:受理号达1117个,通过200个,视同通过67个
• 【独家】2019中国药企ANDA已添23个,昔日霸主华海毫无斩获,各企业赴美热情降低?
• 【独家】一致性评价最新进展:受理号达1051个,通过183个,视同通过65个
• 【独家】2018国内临床试验登记年终报告,一致性评价BE试验占比30%
• 【独家】100个ANDA,24家药企,2018年中国制药国际化道路再创佳绩
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



