FDA近期发布的抗肿瘤药物生殖毒性评估指南草案干货
作者语
2017年9月28日,FDA发布了最新的关于抗肿瘤药物生殖毒性评估的指南草案《Oncology Pharmaceuticals: Reproductive Toxicity Testing and Labeling Recommendations Guidance for Industry》,该指南是对ICH工业S9抗肿瘤药物非临床评估指南的补充。笔者忠实于指南内容,对指南全文进行了汇总和整理,更加便于读者迅速了解指南要点。
一、指南简介
指南目的
本指南的目的是协助申请人进行抗肿瘤药物生殖毒性评估(主要是胚胎发育(EFD)),并为产品标签提供停止治疗后避孕的持续时间提供建议,以尽量减少对发育中的胚胎/胎儿的潜在风险。
2. 指南所涵盖的药物范围
本指南中的抗肿瘤药物是指小分子、治疗性蛋白质、抗体和相关产品如结合物。
本指南不涉及生物类似物、可互换产品、放射性药物、细胞和基因治疗药物或肿瘤疫苗。
3. 指南的主要内容
● 评估各类药物的EFD毒性,以及在什么情况下不需要开展EFD毒性研究。
● 评估针对特定人群药物的EFD毒性研究。
● 使用非临床信息,如基因毒性和一般毒性研究结果来评估是否需要进行针对的EFD研究。
● 关于EFD研究以及男性和女性患者避孕风险的潜在风险(孕妇妊娠分期标记)的标签建议和避孕方法建议,以尽可能减少发育中的胚胎/胎儿的风险(女性和男性生殖潜在标签分段)。
4. 指南的其他说明
(1)本指南没有通过暴露量或剂量来解决安全隐患。对于许多抗肿瘤药物 - 特别是本指南所涉及的小分子药物-没有确定安全边缘(即动物在推荐的与人类剂量相当或低于人类剂量的暴露量条件下观察到胚胎 - 胎儿毒性(国家毒理学计划2013))。
(2)药物开发中的胚胎/胎儿的风险是患者的主要关注点,这也是需要进行EFD研究的原因,因此对于患者的避孕建议应包括在标签中。
(3)本指南并没有解决临床试验期间胚胎/胎儿的潜在风险,因为在相关药物开发过程中必须采取适当的避孕措施。
(4)尽管对于晚期肿瘤症适应症药物,通常不要求开展生殖能力和产前和产后发育(PPND)研究,但是这些研究的一些内容已被纳入本指南中。
二、指南出台的背景
● ICH S9描述了研究新药申请和随后开发抗肿瘤药物所需开展的非临床研究类型和时间。对于ICH S9范围内的药品,要求提交EFD研究结果。
● 在某些情况下,可能不需要进行EFD毒性研究。例如,如果药物正如毒理学研究(ICH S9)所证明的那样,是遗传毒性并且靶向快速分裂细胞,那么该产品被认为是引起致畸性或胚胎 - 胎儿致死率。在其他情况下,可以通过提供风险评估来替代EFD研究。自ICH S9发布以来,FDA已经获得了替代动物生殖毒性研究进行抗肿瘤药物生殖毒性评估的替代方法的经验。
● ICH或FDA针对抗肿瘤药物的指南目前还没有涵盖关于避孕的建议。由于抗肿瘤药物的毒性,需要在避孕措施中采用一致的方法来减少这些产品的暴露量。
三、指南内容
1. 胚胎发育毒性评估
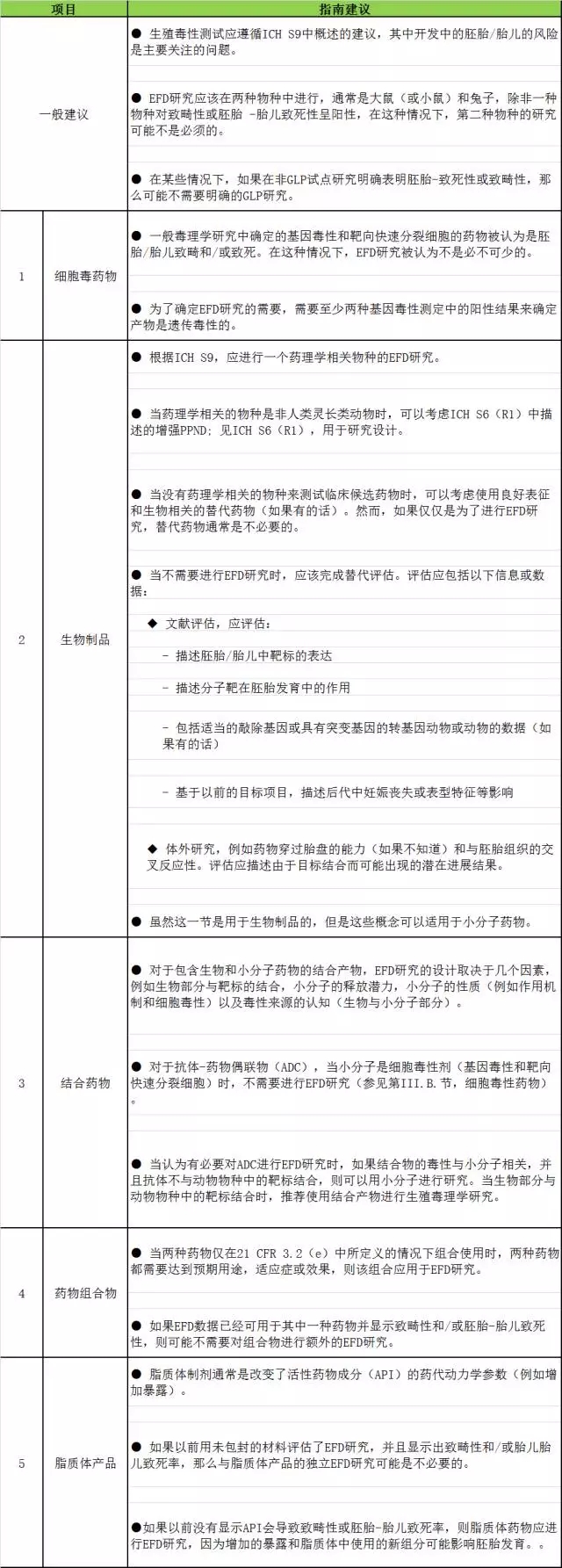
2. 生育能力评估
● 独立生育力和早期胚胎研究通常不是ICH S9范围内治疗晚期肿瘤症患者药品的必要条件。
● 对一般毒性研究中评估的男性和女性生殖器官的影响以及其他相关终点(例如性激素的变化)来评估药物对生育能力的潜在影响。
● 从这些观察确定的任何生育风险,应在标签中的致癌,致突变,生育损害部分描述,并且在标签中的女性和男性生殖潜力部分总结。
● 当药物的适应症不适用于晚期肿瘤症时,通常需要单独的生育力研究。
● 如果基于整体研究数据不能提供有用的信息,独立的生育力研究是不必要的。例如,如果一种药物旨在治疗早期前列腺肿瘤,并且将雄激素降低至阉割水平,则在雄性动物中不需要生殖力研究(因为该药被认为会引起不育症)或雌性动物(因为该药是一种雄性特异性药物)。
● 此外,如果一般毒理学研究结果表明具有不利的生育力影响(例如精子数减少或滤泡损失),通常不需要单独的生育研究。
● 评估临床试验中的睾丸毒性,如行业指南草案所述《睾丸毒性:在药物开发过程中的评估》是不必要的。由于抗肿瘤药物的毒性,临床研究不应在健康受试者中进行,建议的研究设计通常在肿瘤症患者中是不可行的。
3. 产前和产后发育(PPND)的影响
● 对于在ICH S9范围内治疗晚期肿瘤症的药物,PPND研究可能不是必须的。
● 当研究被认为是必要(例如基于适应症)时,应考虑这种研究是否为患者或医师提供信息。
● PPND可能不适用于致畸药物。药物预计会对生存和一般健康产生不利影响,包括后代的发育和发育,并应在标签中妊娠部分传达该风险。
● 对于引起胚胎死亡的药物,应考虑是否有足够数量的后代来评估发育结果。当药物引起胚胎-胎儿死亡时,可以考虑修改PPND研究来增加活产数量,例如在短时间内给药。设计的修改不应该改变PPND研究的目的(例如,出生后给药的起始剂量将仅提供产后增长的信息,但不是必须的)。
4. 评估特定人群风险
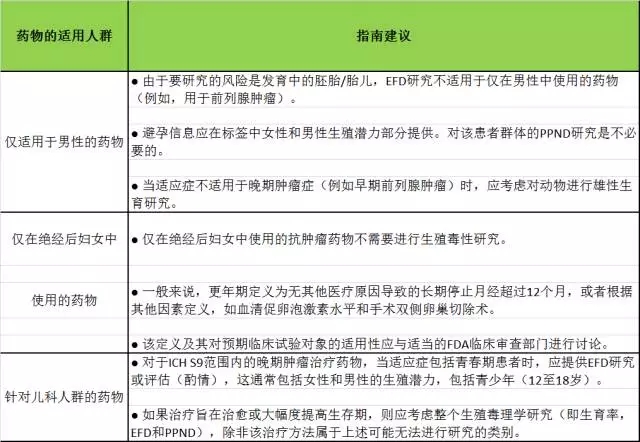
5. 药物动力学数据

6. 关于避孕的建议
● 在确定存在抗肿瘤药物介导的发育毒性的风险后,应向患者提供以下关于停止治疗后避孕持续时间的标签建议。
● 男性和女性生殖潜力的标签应包括男性和女性接受药物后推荐的避孕方法,以尽量减少EFD和男女伴侣接受抗肿瘤药物的风险。
● 尽管以下建议旨在减少母体药物的暴露,但它们也可以酌情降低代谢物暴露所产生的发育毒性(例如,遗传毒性代谢物)。
(1)遗传毒性药物
表1. 遗传毒性(包括安眠药)药物:停止治疗后使用避孕的建议
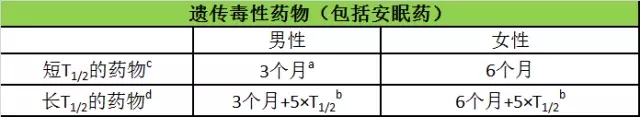
a精子发生的持续时间和无精子的精子的停留时间
b T1/2 =半衰期
c长半衰期指T1/2小于1周
d长半衰期指T1/2大于或等于1周
(2)非基因毒性药物
表2. 非基因毒性药物:停止治疗后使用避孕的建议
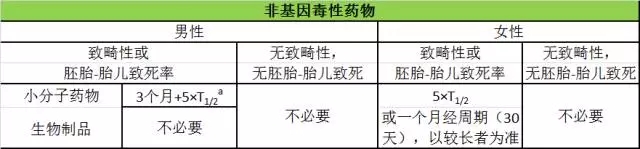
a T1/2=半衰期
参考文献
1. FDA. Oncology Pharmaceuticals: Reproductive Toxicity Testing and Labeling Recommendations Guidance for Industry (DRAFT GUIDANCE). CDER. 2017.9

合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





