CDER是如何评估药物中使用纳米材料所带来潜在风险的?
一、介绍
纳米技术目前作为开发创新产品的手段而正在制药行业应用,包括新剂型,复杂传递系统和靶向治疗。纳米技术在医药行业中的应用可以使药物性能提高,稳定性提高,疗效和患者的依从性增强。FDA支持对开发产品的改进,包括性能,安全性和质量,同时确保将可能风险降至最低。
2011年6月,FDA发布了指南草案《Draft guidance: considering whether an FDA-regulated product involves the application of nanotechnology》,阐明了考虑产品是否含有纳米材料的原则。指南草案中列出的考虑因素虽然不是正式的规定,但与产品可能显示出的最终会引起安全性、有效性、质量或公共卫生影响问题的特性有关,反过来又要求FDA重新审视其审评做法。
为了更好地了解使用纳米材料的后果或风险,FDA采取了几种方法来更好地了解如何在受药物中使用纳米材料。第一步,创建了包含纳米材料的已提交和批准药物的内部数据库,以便更好地了解药物评估和研究中心(CDER)正在审查产品的概况。下一步是评估未来纳米材料对药物产品开发和使用中可能产生的影响。为此,CDER发起了本文中描述的风险评估工作。
2010年,CDER发布了政策和程序指南(MAPP)5015.9,称为“CMC审查中纳米技术相关信息的报告格式”。 在该MAPP中,向CDER的CMC审查人员提供了有关如何从提交的含有纳米材料的产品中持续捕获相关信息,这也是构建数据库的目的。为此,CDER中的CMC审查员被引导到MAPP,收集所有尺寸小于1000 nm产品的信息(不包括溶解的分子实体和生物制剂)。虽然没有FDA对纳米技术的官方定义,但MAPP的目的是CDER使用1000nm尺寸的产品来广泛地建立一些帮助审查员识别应收集纳米技术相关数据的方法。为了了解含有纳米材料药物的质量和安全特性,在数据库中对收集的信息(如粒度,粒度分布等)进行整理和分析。数据库分析的目标是最终确定可能的趋势以及可能有助于纳米材料应用审查方法的概括。药物科学与临床药理学研究室顾问委员会在2012年8月9日的会议上介绍了CDER在治疗药物CMC审查中收集信息的初步分析。
为了从开发和制造的角度确保CDER可以更好地了解在药物中使用纳米材料可能产生的影响,2011年成立了纳米技术风险评估工作组。该小组由一个多学科团队组成,负责评估与纳米技术在药物开发和制造中应用相关的可能风险。
风险评估工作组正在确定CDER目前评估过程中可以进一步优化的与评估产品安全性和质量有关的领域,以专门解决与纳米技术产品特性相关的考虑因素。
工作组有两个主要目标:
1.确定在药物产品中使用的纳米材料所带来的安全性、质量和有效性上的潜在风险。
2. 根据风险管理工作的结果,确定需要改进的领域。
目前CDER的监管要求非常坚决,并且已成功应用于含有纳米材料的新型疗法的评估。本次风险评估工作的目的是全面评估如何优化含有纳米级材料产品的审查实践。最近通过的“食品和药物管理局安全与创新法”重申了更好地了解纳米技术对药物产品的潜在影响的重要性(2012年7月10日签署)。在目前的风险评估工作中,虽然非临床安全评估得到了解决,将重点关注对产品质量的审查。风险评估工作产生的信息将有助于CDER继续确保药物的安全性,有效性和质量,包括那些含有纳米材料的药物,同时牢记药物开发中科学进步的好处。
二、风险评估策略概述
当使用纳米材料进行开发和制造药品时,以下部分描述了纳米技术风险评估工作组使用的发现可能导致质量,有效性和安全性潜在风险因素的策略。根据ICH Q9,风险管理包括风险评估(识别,分析和评估),风险控制(减少和验收)以及风险评估(持续评估和调整)。一些包含设计元素的应用包括了ICH Q9(10)中描述的风险管理工具。此外,基于风险的策略越来越多地应用于含有纳米技术的产品开发中。
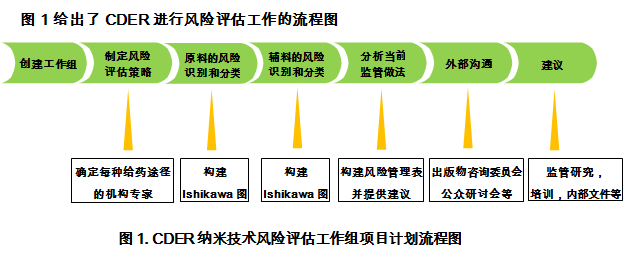
风险评估过程的第一步是组织监管,政策和研究部门组成一个多学科的CDER专家小组。纳米技术风险评估工作组采用传统的风险评估工具,制定了一个战略,即Ishikawa图(也称石川图)(潜在风险识别和分类)与风险的组合管理表,用于描述和分析CDER中使用的当前风险管理方法。在此风险评估工作中,作为API粒度变化的结果,危险或潜在风险因素被定义为可能影响产品质量,安全性和/或有效性的因素。另外工作组根据需要邀请CDER专家进行讨论。
普通给药途径用于组织风险评估工作。选择以下给药途径:口服,皮肤(局部和透皮),吸入和肠胃外。API和辅料都需要评估。一旦发现潜在风险,风险管理表就完成了。对结果进行了分析,以确定建议的优先顺序。
三、风险识别与表征
工作组的做法涉及使用Ishikawa图作为帮助确定可能导致产品或过程特定结果的因素,原因或变化来源的工具。更具体地说,正如ICH Q8(R2)中所述,Ishikawa图识别出“可能对药物产品质量属性产生影响的潜在变量”。 因此Ishikawa图是提供过程中重要因素的清单和识别这些因素之间关系的有用工具。
对于涉及含有纳米材料药物的风险评估策略,该工作组开发了Ishikawa图,确定了在监管审查过程中应该解决的质量,安全性和有效性的潜在风险。例如,对于口服给药途径,选择药物产品的5个阶段用于具体分析:
(1)产品生产
(2)消化和溶出
(3)不吸收颗粒的吸收和分布或
(4)吸收颗粒的吸收和分布
(5)消除。
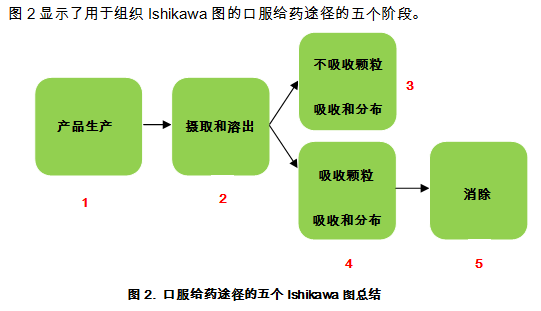
图3提供了口服药物的代表性Ishikawa图的例子,以突出CDER风险评估的工作方法。该图表示在API粒径变化的口服药物摄取和溶出阶段对质量,安全性和有效性的风险。
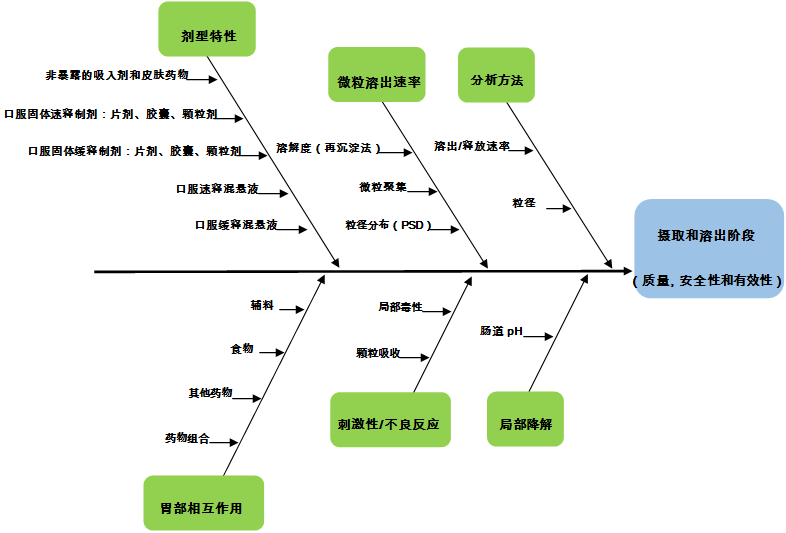
该图表示在API粒径变化对于口服药物在摄取和溶出阶段的安全性,质量和有效性的潜在风险。
对于吸收和分布的Ishikawa图(阶段3和4),考虑了两个主要场景:其中用于吸收(第3阶段或全身递送)的API,另外一个是不适用于吸收(第4阶段或局部作用)的API。由于这两种情况被认为具有不同的风险特征,因此被独立对待。用于吸收(即系统传递)的颗粒的风险评估方法集中在与药代动力学变化相关的潜在危险因素,例如由粒径变化引起的吸收速率和程度的差异。另一方面,对于不适用于吸收(即局部作用)的纳米级颗粒变化,主要考虑由局部作用的API引起的潜在危险因素,例如吸收变化。
本文选择的示例不是对风险评估过程的全面描述。相反,它旨在为CDER如何进行风险评估工作提供一个框架。为了说明方法,以下部分将介绍如何读取Ishikawa图3。
1.Ishikawa图的头部通常表示所需的属性。在所选择的实例的情况下,在考虑非局部作用口服药物的摄取和溶出时,对应于质量,安全性和有效性。
2. 图表顶部和底部的标题框表示影响产品质量、安全性和有效性的相关类别或因素。直接指向这些类别的箭头是主要原因或因素,分支箭头描绘次要原因或因素。例如图3 中的“分析方法”框对应于潜在的风险类别。“溶出/释放速率”和“粒径”的方法研究不足被认为是可能影响质量,安全性和有效性评估的因素。类似地,在“微粒溶出速率”框内,微粒聚集是可能最终影响含有纳米级API药物(摄入和溶出)的质量,安全性和有效性的因素。
Ishikawa图作为对质量,安全性和有效性的潜在危害以及这些可能的危害与彼此之间关系的视觉速写。重要的是,在Ishikawa图中确定的潜在风险是定性的,并且没有对这些潜在的风险因素给出严重程度或概率上的量化。请注意,图中确定的一些潜在风险因素似乎不包含纳米材料产品的独特性,因为确定的某些潜在风险可能通常适用于药物物理性质的任何变化。然而,这些潜在风险被鉴定和分析,因为它们被认为与材料的粒径变化相关。此外,图形表示并不总是捕捉到这些因素与其审查实践的影响之间的复杂关系。
四、风险管理表的开发
随着每个Ishikawa图的开发,创建了风险管理表,用于描述和分析目前用于解决潜在风险的审查实践。
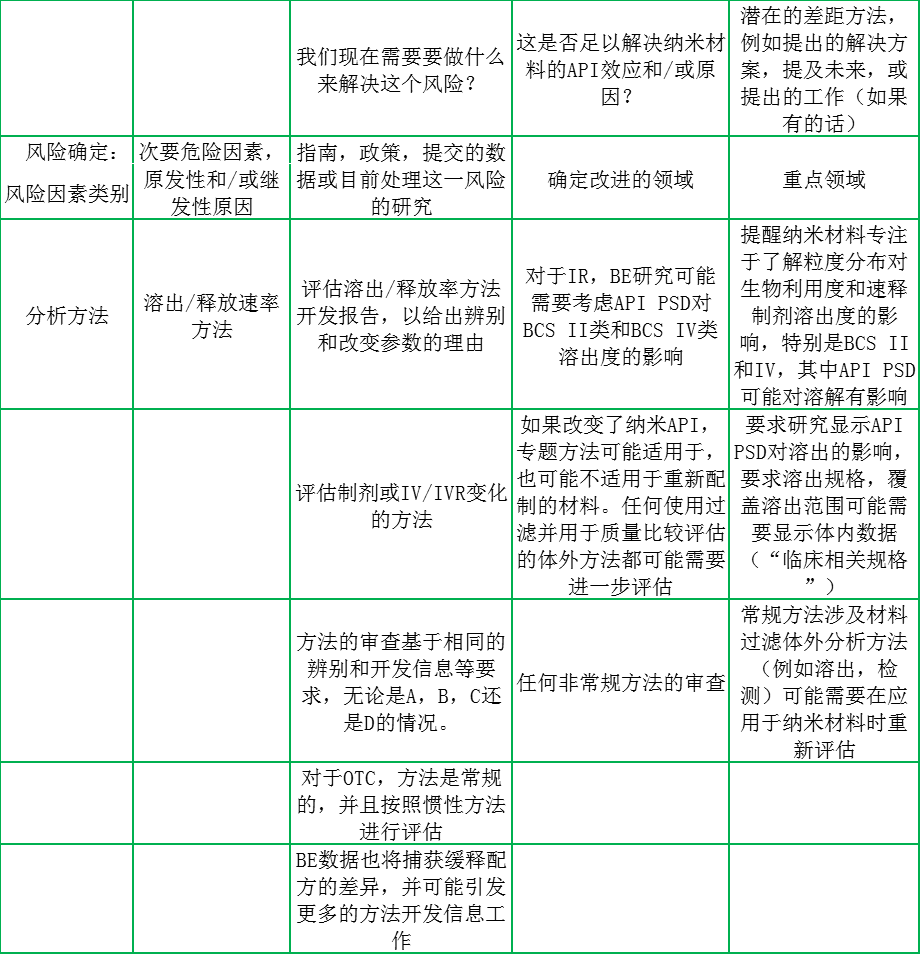
表1列出了风险管理表的一个例子。对于每个风险类别,工作组处理了以下问题,并在风险管理表的不同列中报告出来:
1.评审人员目前评估哪些信息来解决每个潜在风险?在风险管理表的这一列中,该集团列出了目前解决潜在风险的任何指导,政策,提交的数据或研究。
2. CDER纳米技术风险评估工作组确定的潜在风险是否由目前的审查方法来解决?
3. 关于应用纳米技术的药物审查方法的初步建议是什么,以便潜在风险得到适当管理?
由于目前的审查做法对于各种类型提交的药物可能会有所不同,当处理风险管理表中的潜在风险因素时,工作组审议了不同的提交类型,例如501(b)(1),505(b)(2)和505(j)。此外,该小组还考虑了在主要安全性和有效性临床研究完成后可能发生的变化情况。在这种情况下,该小组考虑了在III期临床测试之后,批准之前以及已批准产品的上市后申请批准时API可能发生的变化情况。
表1,对于在摄取和溶出阶段,API粒径变化的口服药物在“分析方法”风险因素分析中的代表性摘要
五、风险评估和建议
所描述的CDER风险评估工作表明,在大多数情况下,如果申请者在开发过程的早期进行适当的研究,目前的审查实践足以评估含有纳米级API的产品。然而,如果粒径的变化是发生在III期临床试验之后或涉及ANDA,工作组确定了CDER可以制定适当审查流程并确定适用的政策。工作组还确定了审查人员的培训教育机会,目的是确保整个审查过程的一致性。
虽然风险管理工作的最终建议尚待完成,但出现了几个关键点。一般来说,工作组确定了可以进行改进的四个方面。这些包括:
(1)改进对纳米材料进行表征的分析方法和对审评员对这些方法进行的培训。
(2)更好地了解粒径变化是如何影响产品性能,包括产品质量的;
(3)在某些情况下,通常不需要安全性试验或可能有意外暴露量的情况下,还需要确定适用的政策;
(4)开发与纳米技术相关审查人员的培训教育机会。
CDER中的审查和研究人员目前正在处理上述四个方面。
六、总结
本文介绍了CDER纳米技术风险评估工作组开展的一个框架,以确定与药物产品中使用纳米材料相关的潜在风险的框架。以口服给药途径为例,描述了CDER在执行风险评估工作中使用的工具。工作组正在对一些给药途径,辅料和药物开展类似的实践。这些实践将导致利益相关者和CDER工作人员之间的未来讨论,以形成对纳米技术相关产品开发和产品审查的共同理解,以确保产品质量,安全性和有效性。
参考文献
Celia N. Cruz, Katherine M. Tyner, Lydia Velazquez, et al. CDER Risk Assessment Exercise to Evaluate Potential Risks from the Use of Nanomaterials in Drug Products. The AAPS Journal, Vol. 15, No. 3, July 2013 DOI: 10.1208/s12248-013-9466-6
原创申明:本文系药智网原创稿件,欢迎转载,转载请注明来源和作者,谢谢!

合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





