口服固体药品重新包装成单剂量后,如何豁免稳定性研究和指定有效期?
将口服固体药物产品重新包装在单剂量包装中,无论对于医疗机构,还是患者本人都是非常方便的,这将使药品具有更加良好的依从性。因此再过去几十年来,对于口服固体药品重新包装成单剂量的需求不断增加。但单剂量重新包装导致了关于这些重新包装药品的稳定性研究和合适有效期(expiration date)的问题。鉴于此,2017年8月8日,FDA发布了关于单剂量重新包装口服固体药品有效期的指南,即《Expiration Dating of Unit-Dose Repackaged Solid Oral Dosage Form Drug Products》(Final Guidance)。与之前USP总则第1178章“良好再包装管理规范(GPP)”中确定单剂量重新包装口服固体药品有效期的建议不同,本指南描述了FDA豁免这些重新包装产品所需进行稳定性研究和根据这些条件对有效期的指定。笔者将浓缩该指南中的精华内容,与读者分享。由于笔者能力有限,对指南内容的理解有可能存在偏颇之处,还请相关专家和读者斧正。
注:本草案取代了2005版的《Expiration Dating of Unit-Dose Repackaged Drugs: Compliance Policy Guide》。
一、本指南适用的产品范围
1.指南涉及将商业市售药物重新包装至单位剂量容器中的处方药和OTC药物。这些药物应当是根据“联邦食品,药物和化妆品法案(FD&C Act)”第510款向FDA注册,并符合21 CFR 210和211中CGMP的规定。
注:规定的重新包装的生产或加工过程包括重新包装或以其他方式更改任何药物包装的容器,包装或标签,以进一步将药物从初始生产地点分配给最终交付或销售给最终消费者的人员手中。
2.指南不涉及以下产品的重新包装:
●其他剂型(例如无菌、液体、局部)。
●根据FD&C法第503B条定义的国家许可药房,联邦设施和外包设施重新包装的产品。
注:国家许可药房,联邦设施和外包设施进行的重新包装将由单独的指南来解决。 例如,参考药房和外包设施对行业重新包装人用药品的指南。
二、本指南出台之前的规定要求
1.根据FDA对成品药品的cGMP规定要求。每种药品都应有通过稳定性试验确定的合适的有效期。日期必须与稳定性研究(§§211.137(a)和(b))确定的标签上规定的任何储存条件相关。单剂量包装药品的有效期应置于主要容器上,除非不可行。
2.用于稳定性测试的样品必须与市售药品具有相同的密封容器系统(§211.166(a)(4))。这是为了确保药品在其预期货架期内的安全性和有效性,并确保在药品预期货架期内出现质量问题时,可以获得代表市售产品的数据。
3.美国药典(USP)总则第7章标签规定:“官方药品的标签应当包含有效期”。对于单位剂量重新包装的产品,USP总则第1178章“良好再包装管理规范(GPP)”建议有效期不超过:(1)从重新包装之日起6个月;或(2)生产厂家指定的有效期;或(3)重新包装日期和正在重新包装的生产厂家散装产品容器上显示的药物有效期之间的25%。以较早者为准。
三、本指南的具体要求
对于将药物重新包装到单剂量包装的中口服固体制剂,FDA不打算根据§§211.137和211.166(即通过稳定性研究确定有效期)的要求来执行,即豁免这些重新包装产品所需进行稳定性研究和根据这些条件对有效期的指定。但需要满足一定的条件。这其中存在两种情况:
情况1.如果这些产品被指定的有效日期不超过以下两个条件中较短的时间:
(1)自重新包装之日起6个月;
(2)重新包装日期和正在重新包装的生产厂家散装产品容器上显示的药物有效期之间的25%。
笔者举例(笔者自身对于本指南的理解,并非指南正文内容)
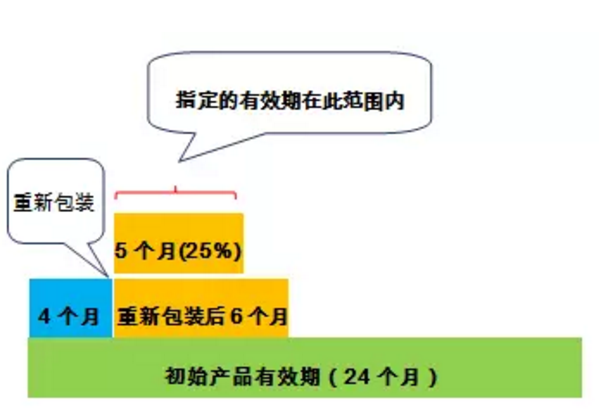
情况1同时需要满足以下条件:
(1)单剂量容器符合USP一般章节<671>容器-性能测试“单组分容器和固体口服剂型单剂量容器包装系统分类”中所述的A类或B类标准。”但满足USP <671> C级和D类标准的容器不符合此条件。
在这种情况下,只有(a)有B类材料的透湿性和药物产品的水分敏感性的合适数据;并且(b)对这些数据进行了风险评估,确保使用这种容器不会在整个指定的有效期期间损害产品的质量,这样才能使用符合B类标准的容器。
(2)如果正如生产商所指出的那样,药品对光敏感(如标签上的“避光”),则单剂量重新包装容器密封系统应提供等于或大于产品原包装容器密封系统的光保护作用。
(3)药品原装容器以前未开封,并且一次性完成全部重新包装。
(4)重新包装和贮存应处于与原始药品标签中描述的条件一致的环境中。如果原始标签中没有规定温度和湿度,在重新包装过程中,产品应保持在“受控室温”和“干燥处”(如USP <659>包装和储存要求中所定义的),包括贮存。
(5)药品的标签没有警示不允许重新包装。例如说明书中明确规定“应保持片剂在原始容器中”和“不允许重新包装”。
情况2.如果这些产品被指定的有效日期超过以下两个条件中较短的时间:
(1)自重新包装之日起6个月;
(2)重新包装日期和正在重新包装的生产厂家散装产品容器上显示的药物有效期之间的25%。
笔者举例(笔者自身对于本指南的理解,并非指南正文内容)
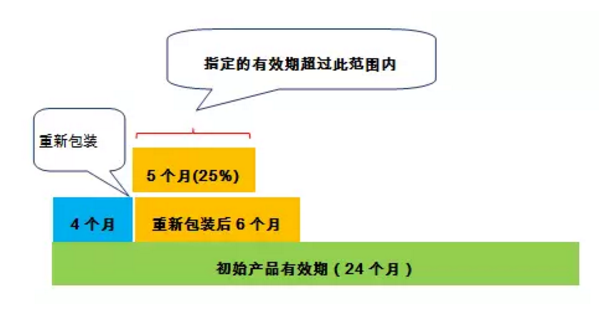
情况2同时需要满足以下条件:
(1)满足上述情况1中的五个条件。
(2)使用足够数量样品进行的合适研究的支持性数据表明,用于重新包装的容器密封系统至少能与原始包装一样,对药品提供同样的保护。容器封闭系统的比较可以通过几种方法进行,例如,根据需要测试阻止水分,氧气和光照的情况; 通过压力测试将原始容器密封系统的性能与新系统进行比较,包括在极端条件(例如高温和高湿)下贮存后的产品测试和长期或加速条件下储存后的降解试验。适当的研究应以健全的科学和基于风险的评估为基础,以确保产品质量保持到有效日期。
(3)重新包装的产品有效期不应超过原产品的有效期。

合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





