8个新药品种上市(附名单)
10月药审速览:CDE共受理药品注册申请1091个品种,包括137个1类创新药,45个2类改良型新药,以及3个中药经典名方。在审批方面,完成审批共计843个品种,批准临床207个品种,批准生产134个品种,批准进口2个品种,未被批准60个品种。
值得关注的是,1类创新药获批5个品种,2类改良型新药获批2个品种,3类经典名方获批1个品种,共计8个新药品种上市(详见下表2)。
01 受理情况
CDE共受理药品注册申请1091个品种(受理号1471个)。按药品类型统计,化药仍为主体,达639个品种;中药173个品种;生物制品274个品种。按审评任务类型统计,受理新药临床试验申请(以下简称IND)172个品种;新药上市许可申请(以下简称NDA)32个品种;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)207个品种;仿制药质量和疗效一致性评价注册申请(以下简称一致性评价申请)13个品种。
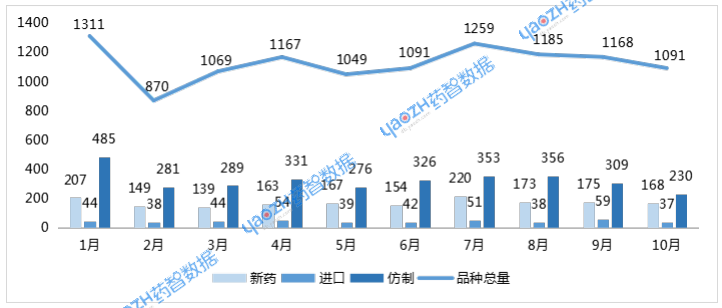
图1 2025年1-10月受理品种情况
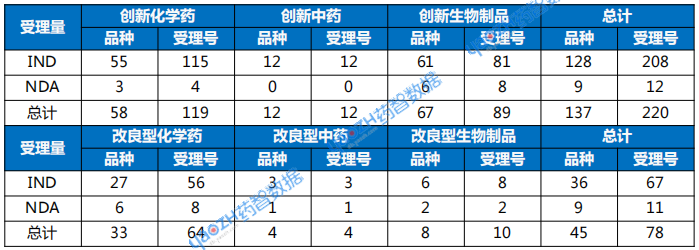
以注册分类统计,1类创新药受理137个品种。IND申请128个品种,NDA申请9个品种。2类改良型新药注册申请受理45个品种,化药申请33个品种,中药申请4个品种,生物制品申请8个品种。
亮点速览
•华海药业控股子公司华奥泰提交了「瑞西奇拜单抗注射液」的上市申请,用于治疗泛发性脓疱型银屑病急性发作,这是首个申报上市的国产IL-36R单抗,也是华海药业首个申报上市的创新药品种。
•石药集团附属公司「依达格鲁肽α注射液」上市申请获受理,此次上市申请主要基于一项关键Ⅲ期临床试验——与安慰剂相比,该产品可显著降低体重,并可显著降低患者的腰围、血糖、血压、血脂等指标,为患者带来心血管及代谢综合获益。
•朗来科技自主研发的化学药品1类创新药「MY008211A片」结束拟优先审评品种公示期,被CDE正式纳入优先审评品种名单,用于阵发性睡眠性血红蛋白尿症。该品种的新药上市许可申请已于10月17日被成功受理,进入注册审评阶段。
表1 2025年10月创新药与改良型新药注册申请受理情况
中药3类经典名方注册申请受理3个品种,为上海凯宝药业的桃红四物颗粒,四川光大制药的半夏白术天麻颗粒,华润三九(雅安)药业的真武汤颗粒。
3类化学仿制药注册申请受理79个品种,4类化学仿制药受理152个品种。中药同名同方药10月无受理品种。生物制品3.3类生物类似药受理5个品种,其中预防用生物制品2个品种,治疗用生物制品3个品种。
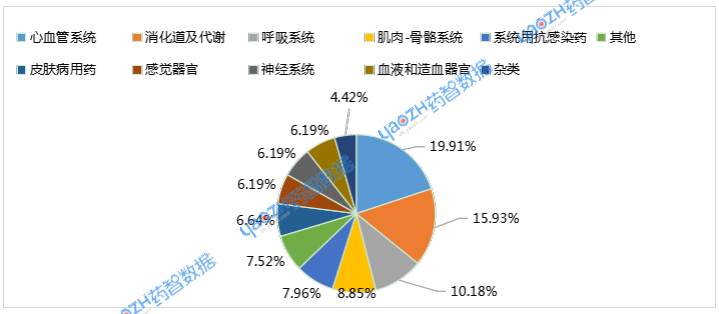
图2 2025年10月化学仿制药申报品种ATC分布情况
02 完成审批情况
NMPA完成审批843个品种(受理号1097个),其中化药443个品种,中药260个品种,生物制品137个品种。以审评任务类型统计,IND申请完成审批151个品种,NDA申请15个品种,ANDA申请156个品种,一致性评价品种28个品种。按药智审评结论统计,批准临床207个品种,批准生产134个品种,批准进口2个品种,未被批准60个品种。
以注册分类统计,1类创新型新药完成审批117个品种,IND申请完成审批111个品种,临床申请批准率为100%;NDA申请6个品种,上市批准率为83%。2类改良型新药完成审批40个品种,IND申请完成审批36个品种,临床批准率为100%;NDA申请完成审批4个品种,上市批准率为50%。中药经典名方完成审批2个品种,上市批准率为50%。
新药上新
•和美药业「莫米司特片」是我国首个自主研发并获批的PDE4抑制剂,也是全球首个具备磷酸二酯酶4B(PDE4B)蛋白表达阻断剂和PDE4抑制剂双重机制的小分子药物。
•科伦博泰生物自主研发「博度曲妥珠单抗」国内上市!此次获批使博度曲妥珠单抗成为中国首个可以广泛覆盖二线及以上HER2阳性乳腺癌患者的国产HER2 ADC药物。本次获批基于一项多中心、随机、开放标签、对照的III期KL166-III-06研究,研究结果已在2025年欧洲肿瘤内科学会(ESMO)年会上以口头报告形式公布。
•华东医药全资子公司杭州中美华东申报的化药1类新药「瑞玛比嗪注射液」获批上市,该产品是一种注射用外源性荧光示踪剂,需与经皮肾小球滤过率测量设备(TGFR)配合使用,评估患者的肾小球滤过率(GFR)。瑞玛比嗪注射液与TGFR组成MediBeacon®TGFR。MediBeacon®TGFR是全球首个获批用于肾功能正常或受损患者肾功能评估的床旁产品。
•乐普生物的「注射用维贝柯妥塔单抗」获优先审评审批程序附条件批准,用于既往经至少二线系统化疗及PD-1/PD-L1抑制剂治疗失败的复发/转移性鼻咽癌成人患者的治疗,是国内首个获批上市的EGFR ADC药物。
3类化学仿制药申请完成审批51个品种,批准临床6个品种,批准生产35个品种,未被批准9个品种。4类化学仿制药申请完成审批109个品种,批准临床1个品种,批准生产92个品种,未被批准16个品种。3.3类生物制品生物类似药完成审评4个品种,批准临床3个品种,未被批准1个品种。
表2 2025年10月新药上市申请审评结论情况
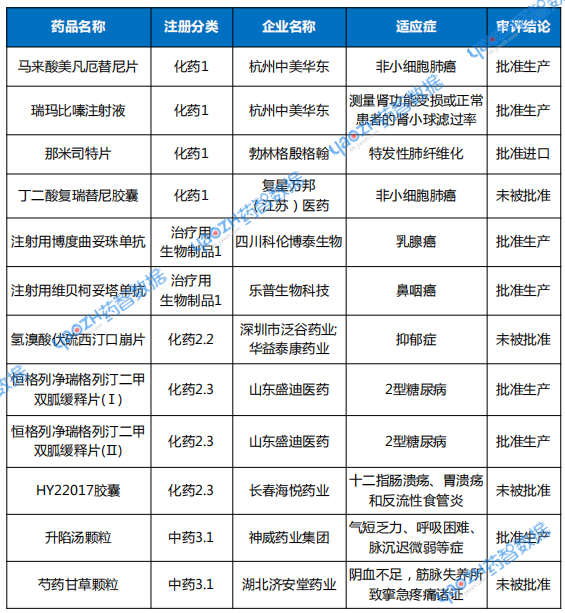
注:数据统计至2025年11月5日
03 优先审评与突破性治疗品种名单
CDE共将3个品种正式纳入优先审评,1个品种在拟纳入公示名单阶段。3个化药品种,1个生物制品品种,中药未有品种纳入优先审评。纳入优先审评理由涉及“附条件批准”“纳入突破性治疗药物程序”等。
突破性治疗品种名单有5个品种,仅有1个化药品种,生物制品4个品种。涉及糖尿病、实体瘤等适应症。
表3 2025年10月优先审评与突破性治疗品种名单
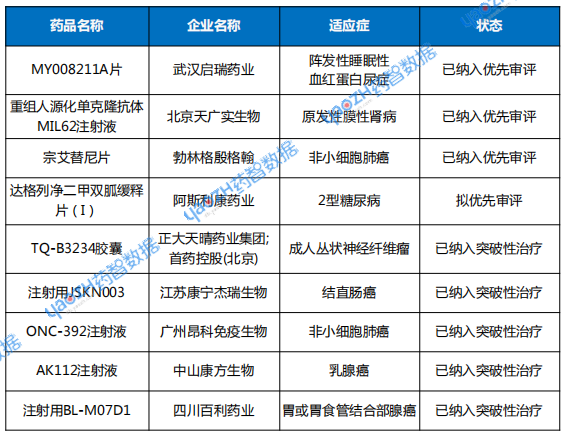
注:数据按公示日期进行统计。
数据来源:药智数据企业版——药品注册与受理数据库


责任编辑:琉璃
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



