GSK重磅产品“复活”
今日GSK宣布,美国FDA已批准其BCMA ADC药物Blenrep(belantamab mafodotin)上市,联合硼替佐米和地塞米松(BVd),用于治疗至少接受过两种既往疗法的复发或难治性多发性骨髓瘤(RRMM)成年患者。
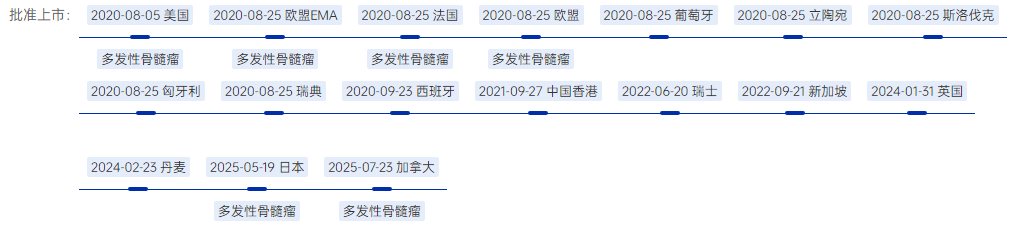
值得注意的是,Blenrep曾在2020年通过FDA加速批准通道上市,单药用于r/r MM患者的后线治疗,成为首款获批上市BCMA ADC药物。
不过,在随后的明确验证性3期临床DREAMM-3试验(Blenrep单药VS泊马度胺+地塞米松)临床失败,GSK在2022年11月启动该药在美国的撤市程序。
此次批准,意味着Blenrep已成功“复活”,获得重返美国市场的资格。
图片来源:药智数据-全球药物分析系统
Blenrep是一款靶向B细胞成熟抗原(BCMA)的ADC,抗体采用协和发酵麒麟子公司BioWa的POTELLIGENT技术,通过去岩藻糖增强ADCC活性。ADC构建方面,采用非裂解linker偶联auristatin F毒素,Linker从Seagen授权引进。
FDA的此次批准是基于关键性3期临床试验DREAMM-7的数据。
分析显示,在既往接受过至少两线治疗(包括一种蛋白酶体抑制剂和一种免疫调节剂)的患者中,与基于达雷妥尤单抗的三联疗法(DVd)相比,Blenrep联合疗法将死亡风险降低51%(HR=0.49,95%CI:0.32–0.76),并且中位无进展生存期(PFS)延长至3倍,达到31.3个月,而DVd组为10.4个月。
Blenrep联合疗法的安全性和耐受性特征与各单药的已知特征基本一致。
此前,2025年7月,Blenrep已获得欧盟(EU)批准,联合硼替佐米和地塞米松(BVd),用于既往接受过至少一线治疗的复发或难治多发性骨髓瘤成人患者;或联合泊马度胺和地塞米松(BPd),用于既往接受过至少一线治疗(包括含来那度胺的治疗)的复发或难治多发性骨髓瘤成人患者。
在中国,GSK已于2024年底提交Blenrep(玛贝兰妥单抗)的上市申请,并被CDE纳入优先审评和突破性治疗品种,针对适应症为与硼替佐米和地塞米松联合,用于治疗既往接受过至少一种治疗的多发性骨髓瘤成年患者。
另外,GSK正力图将Blenrep应用前移至更早治疗线。
对DREAMM-7和DREAMM-8的总生存期(OS)继续进行随访,预计将于2028年初公布数据,包括仅接受过一种先前治疗的患者。
GSK还在2024年11月启动了一项针对新诊断MM患者的3期临床研究DREAMM-10,旨在对比Blenrep+来那度胺+地塞米松与达雷妥尤单抗+来那度胺+地塞米松用于不适合自体干细胞移植的新诊断多发性骨髓瘤(MM)的无进展生存期(PFS)和微小残留病灶(MRD)阴性率。
GSK曾在其投资者会议上,提出了Blenrep的销量峰值可能会达到30亿英镑的豪言壮志。

图片来源:GSK官网
参考来源:药智数据-全球药物分析系统,GSK公开资料


责任编辑:琉璃
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



