声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。
干货!创新制剂IND,CMC研究的那些关键点
药品三大属性:安全、有效、质量可控。质量可控,对应的是药学研究,关联的是CMC,是药物进行安全性、有效性研究的基础,也是整个药物开发的基石,不容有失。进一步细分,质量可控对应两个物质基础,原料药&制剂。原料药IND阶段的药学研究已有很多同行进行总结,现在此重点对制剂的IND药学研究进行细述。(PS:全文以化药创新药为研究背景。)
1.IND药学制剂-前期可以获得的信息基础
创新药,除了长周期、高风险、“高利润”的习惯性标签外,实际上更重要的技术特点还有阶段性、渐进性、不确定性。
对于Ⅰ期临床申请,安全性是评价的核心;且往往由于受试者少,暴露时间相对较短,通常不需要提供完整的药学研究信息,药学审评重点为安全性相关问题,如杂质、稳定性、无菌制剂的生产条件和灭菌/除菌方法等。
基于上述药学工作的一个研究逻辑和基调,药学制剂工作的开展还需要拿到尽可能多的原料药开发信息,如原料药的早期物化数据、早期质量研究数据、早期稳定性数据等。由于早期的创新药制剂剂型多为经典剂型,如普通片剂、胶囊剂、颗粒剂、注射剂,相对较少的接触微球、微囊、脂质体等;因此留给制剂学科的开发时间通常不多,也很少将不易解决的技术难题放在制剂学科。故,在上述研究策略、研究逻辑的基础上,创新药早期制剂工作开展相对要求快一些。
2.I期临床试验~制剂要求&具体内容
早期新药的制剂研究,通常不会占比较多的项目运转时间,所以,必须要明确做哪些最为基础的项目以支撑IND及安全性的要求。
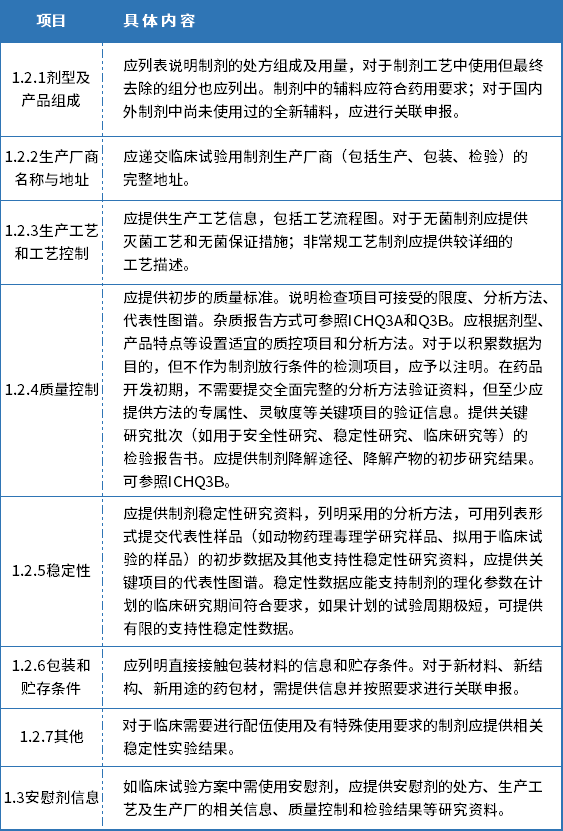
国内可重点关注《新药I期临床试验申请技术指南》,其对制剂需要做的具体内容和要求具有非常重要的指导作用。如,制剂处方组成、工艺描述、试制规模、灭菌除菌、质量控制、项目限度、溶出释放、批分析、关键质量属性、稳定性考察、降解产物研究,等等。具体内容可见下表。
表2.1I期临床试验-制剂要求
3.临床样品制备要求
物质基础的来龙去脉,可以更好地解释IND药学研究的制剂要求。
2008年7月FDA发布了《Ⅰ期临床试验用样品的生产质量管理规范》,详细阐述了Ⅰ期临床试验样品生产落实cGMP的问题,建议采用药物质量控制原则作为cGMP的一部分保证Ⅰ期临床试验样品的质量和安全性。该指导原则对确定Ⅰ期临床试验样品的生产环境给出了详细建议,详细阐述了Ⅰ期临床试验用样品推荐的cGMP要求,对国内创新药早期临床试验样品的制备有较好的参考意义。
此外,国内更为重要的一个临床样品制备指导原则,源自2022年5月,国家药监局关于发布的《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告(2022年第43号),其中对范围、原则、质量管理、人员、厂房设施设备、物料管理、文件管理、制备管理、质量控制、放行、发运、投诉召回、收回销毁等进行了详细的介绍。同时,还对相关问答进行了发布,具体如下图所示。
表3.1《药品生产质量管理规范》临床试验用药品
附录相关问答

4.药学制剂-具体研究要做到什么程度?
通常,I期临床试验使用的剂型比较简单,如胶囊、混悬液、溶液,重点是保障临床试验样品的稳定、安全。对于临床试验拟用制剂和毒理学试验所用制剂在生产、特性方面的差异,应讨论这些差异对安全性可能的影响程度,从而保证用于临床前动物试验、临床试验等所用药物的质量具有可比性。
再如,质量控制,应对涉及安全性的有关物质、遗传毒性杂质等检测方法的适用性进行初步验证,初步界定杂质谱;限度应基于已有批分析数据的积累,临床样品的杂质水平不得超出动物安全性试验数据所支持的相应杂质的水平;并提供已有批次(如安全性评价、稳定性试验等)和拟进行临床试验批次(如有)的批分析数据。
另,稳定性研究提供已有的稳定性试验结果、后续的稳定性研究计划;对于复溶、稀释或混合后多次应用的制剂,应开展使用中的稳定性研究;建议开展影响因素等试验,以了解药物的内在稳定性情况、潜在的降解途径,帮助稳定性试验条件的选择、分析方法的考察。已有的稳定性研究结果应支持拟进行的临床研究,保证拟定临床试验期间药品质量的稳定。
针对一些共性问题,国家局也发布了《化学药品创新药I期临床试验申请药学共性问题相关技术要求》,其中关于制剂方面的内容,具体如下。
表4.1I期临床试验-制剂共性问题

5.未来还有哪些工作要做?
上述,即为IND阶段对于药学制剂相关内容的研究要求,实质上对于I/II期临床阶段的制剂,上述要求大方向都是符合的(前提~安全性)。为了进一步的了解和比较未来Ⅲ期临床试验药学制剂需要怎样的要求,根据CDE发布的《创新药(化学药)Ⅲ期临床试验药学研究信息指南》总结关于制剂的内容如下表所示。
表5.1Ⅲ期临床试验-制剂要求

参考:
1.化学药物综述资料的撰写格式和内容的技术指导原则——药学研究资料综述
2.《新药I期临床试验申请技术指南》
3.化学药品创新药I期临床试验申请药学共性问题相关技术要求
4.《药品生产质量管理规范(2010年修订)》临床试验用药品附录的公告
5.《药品生产质量管理规范》临床试验用药品附录相关问答
6.创新药(化学药)Ⅲ期临床试验药学研究信息指南
7.ICH指导原则M系列
8.ICH指导原则Q系列

责任编辑:三七




合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



