深度盘点:2021年CDE受理1439个国产1类创新药注册申请,中药申报数量创新高!
辞旧迎新贺新年,在这充满艰难困苦的一年中,国内药品注册仍处于一个蓬勃发展的状态,近6年内,CDE承办受理号数量显著攀升;截止至2021年12月31日,CDE审评中心共受理11569个受理号(数据统计截止2021年12月31日,下同),申报临床和生产的数量与2020年相比有显著提升,其中申报临床的有2452个受理号,申报生产的有2157个受理号。以下为详细的2021年受理情况分析:
/ 01 /
2021年药品注册申请受理总体情况
1.各药品类型申报情况
就承办受理号总量,从2016年申报3779个(以受理号计)到2021年的11569个,数量逐年攀升;其中2021年承办化药申请受理号8174个,与2020年的7907差别不大,生物药2022个,与2020年的1868个相差仅154个,同样无太大差异,但中药2021年申报较2020年的472有显著提升,为1371个,达到近6年中药申报数量的巅峰。
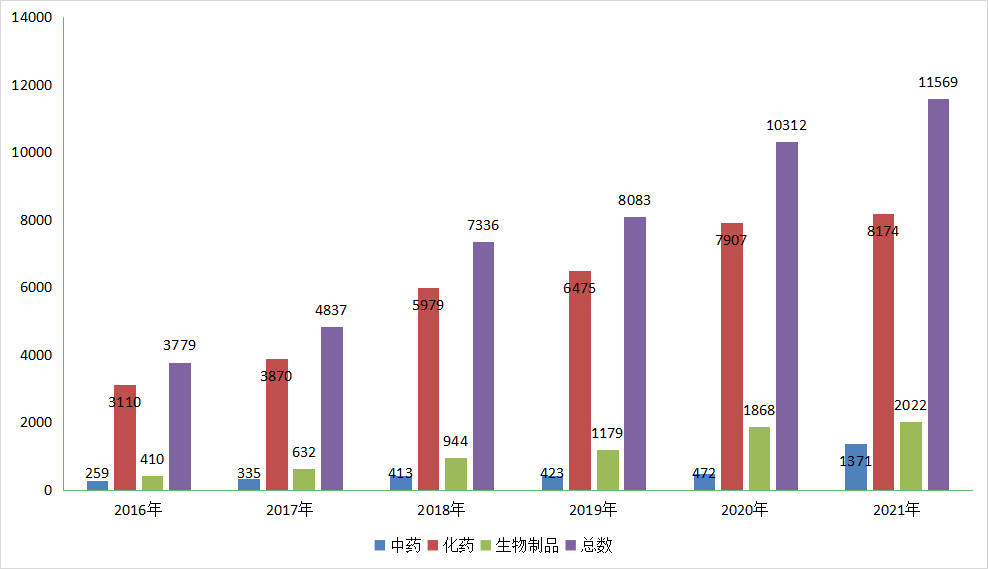
图1 2021年申报详情
数据来源:药智数据、药智咨询整理
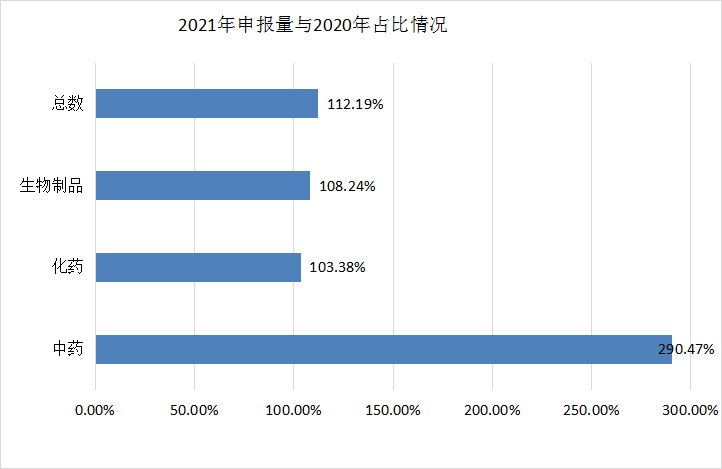
图2 2021年申报受理情况与2020年比较情况
数据来源:药智数据、药智咨询整理
2.每月申报情况
2021年1-5月受理数量与2020年相比基本一致,2021年下半年申报数量明显高于或与2020年同期基本持平的状态,但2020年和2021年的申报数量明显高于2019年。近3年每月受理对比情况详见图3。
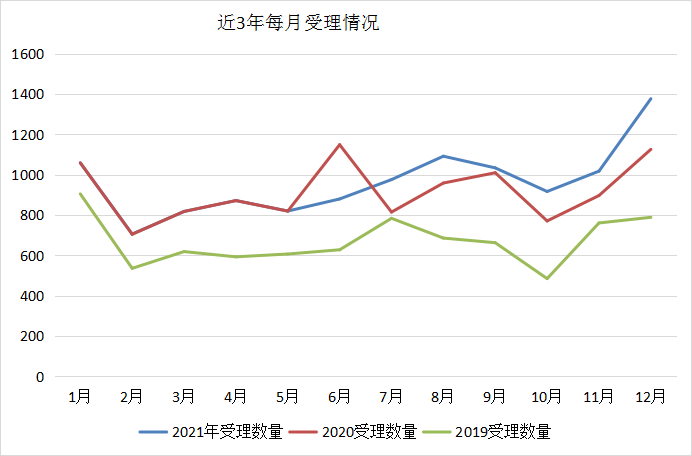
图3 近3年每月受理对比情况
数据来源:药智数据、药智咨询整理
3.各类申报类型总体情况
2021年全年的申报类型占比和2021年上半年申报情况基本一致,仍旧以补充申请为主,占据整个申报类型的大壁江山,为6089个,报临床的受理号有2452个,报生产的受理号为2157个,申请再注册的数量为377个。与2020年相比,补充申请所占比例由65.21%下降到54.98,而申请临床和申请生产的数量有明显提升,分别从16.85%提升到22.14%和从14.58%提升到19.48%。2020年和2021年CDE 药品各申请类型受理情况见图4和图5。
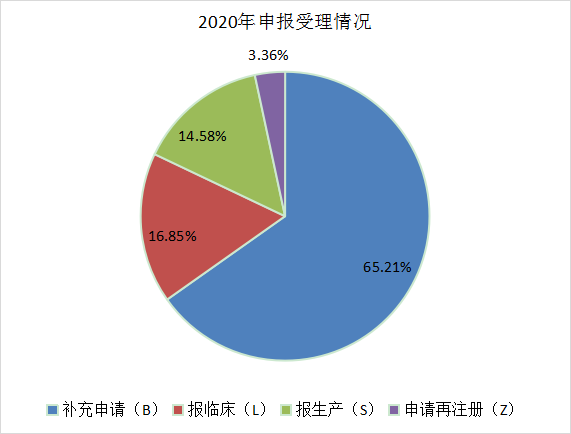
图4 2020年申报受理分类
数据来源:药智数据、药智咨询整理
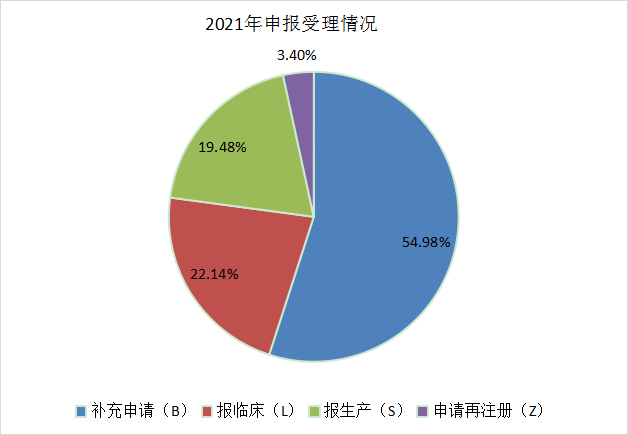
图 5 2021年申报受理分类
数据来源:药智数据、药智咨询整理
注:统计规则:S、L、B、Z 分别是受理号第 4 位字母
4.国产创新药受理情况
2021年CDE受理国产1类创新药注册申请1439个,其中受理临床申请1383个,上市申请52个。按药品类型统计,化学药896个,生物制品合计489个(其中治疗用生物制品481个),中药54个。具体申报情况见图6。
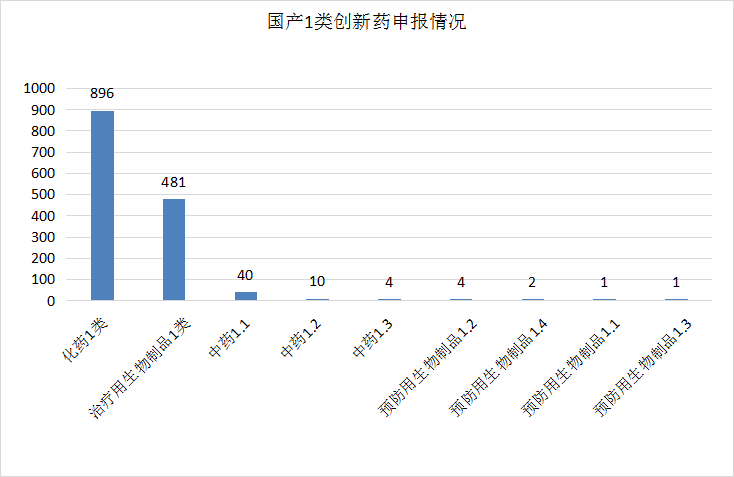
图6 国产1类创新药申报情况
数据来源:药智数据、药智咨询整理
5.进口创新药及原研药受理情况
2021年CDE受理5.1类化学药进口原研药注册申请169个,受理1类进口创新药注册申请264个;1类治疗用生物制品133个和1个1.1类预防用生物制品。
6.2021年申报并完成审评情况
根据药智注册与受理数据库最新统计,2021年(注:CDE承办日期从2021年1月1日至2021年12月31日)审评完结受理号数量(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)共计5414个,其中化药4414个,中药206个,生物制品792个。2021年承办并获批情况详见图7。
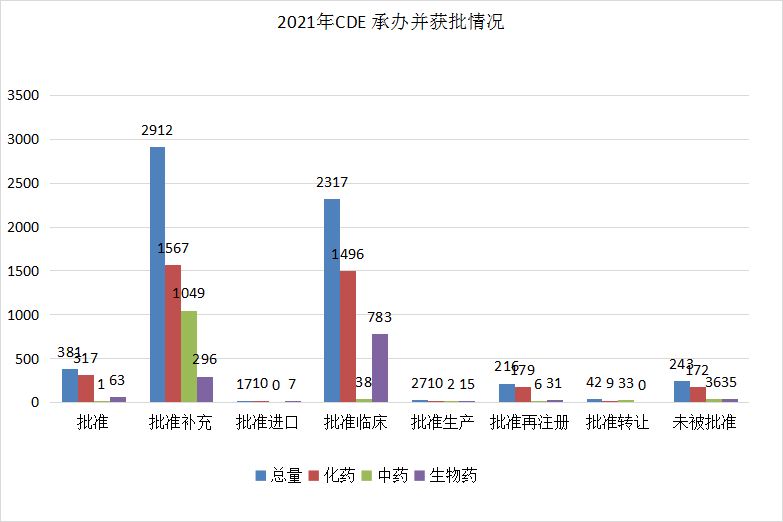
图7 2021年CDE承办并获批情况
数据来源:药智数据、药智咨询整理
7.2021年审评完结情况
根据药智注册与受理数据库最新统计,2021年(注:状态开始时间(药智)从2021年1月1日至2021年12月31日)审评完结受理号数量为11210个,药智收录到结论的数量为11021个受理号,其中化药7874个,中药1316个,生物制品1832个。2021年CDE审评完结结论详情统计见图8。
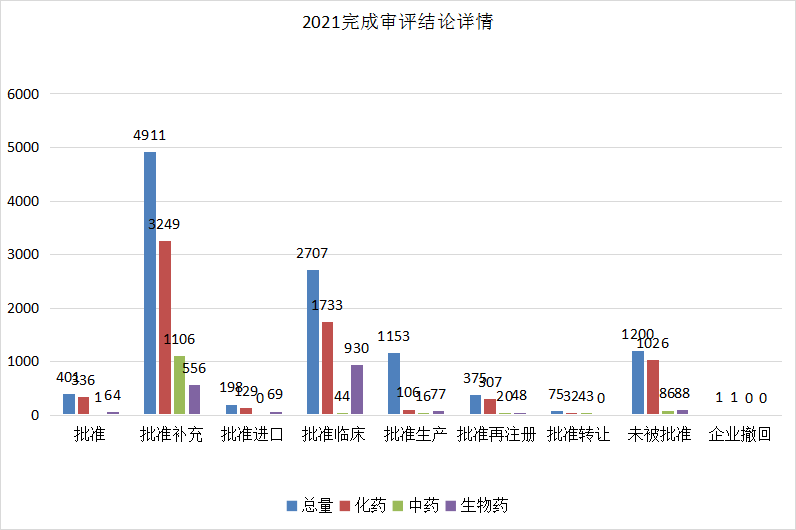
图8 2021 年CDE完成审评结论详情
数据来源:药智数据、药智咨询整理
8.申报地区情况
在各省市的药品申报方面,2021全年申报情况和2021上半年一致,江苏以1750遥遥领先,其次上海以1307屈居第二,随后依次为北京、广东、浙江。2021年各省市申报情况见图9。
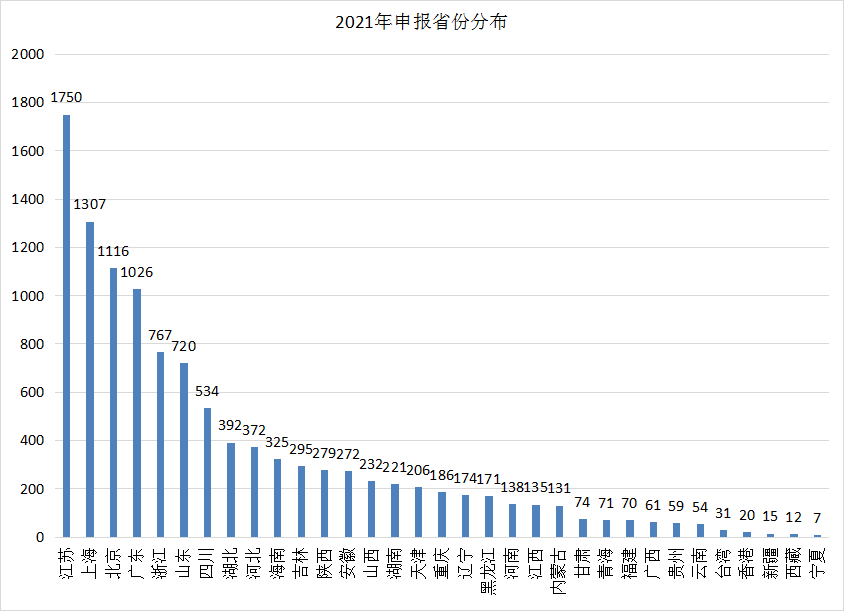
图9 2021年各省份申报分布
数据来源:药智数据、药智咨询整理
以下让我们详细分析一下化药、中药、生物制品、优先审评和突破性治疗的注册受理及审评情况。
/ 02 /
化 药
1.2021年化药申报情况
2021 年CDE共承办新的化药注册申请以受理号计有8174个。2021年每月 CDE 化药受理情况详见图10。
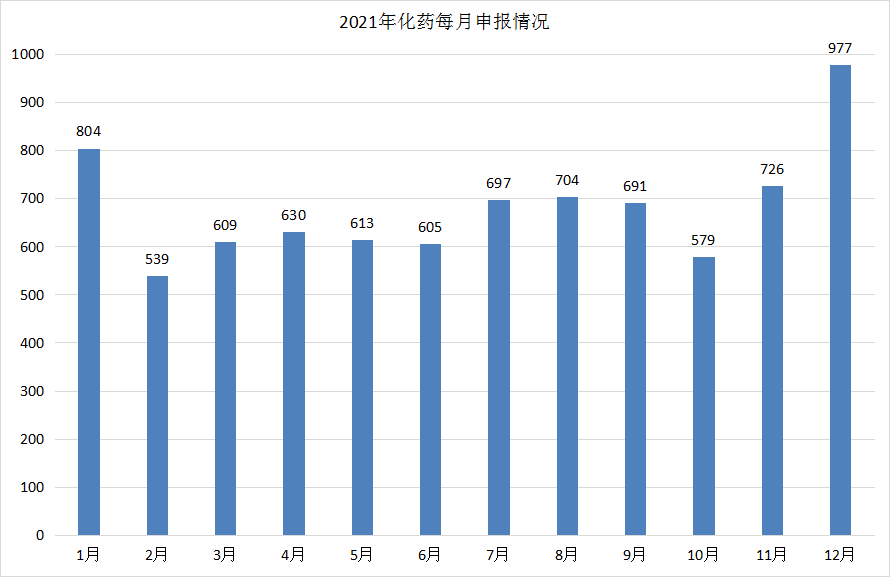
图10 2021年化药申报受理情况
数据来源:药智数据、药智咨询整理
化药注册申请按任务类型分类,IND受理申请1485个,NDA受理申请199个,ANDA受理申请1794个;2021年化药任务类型分类情况详见图11。
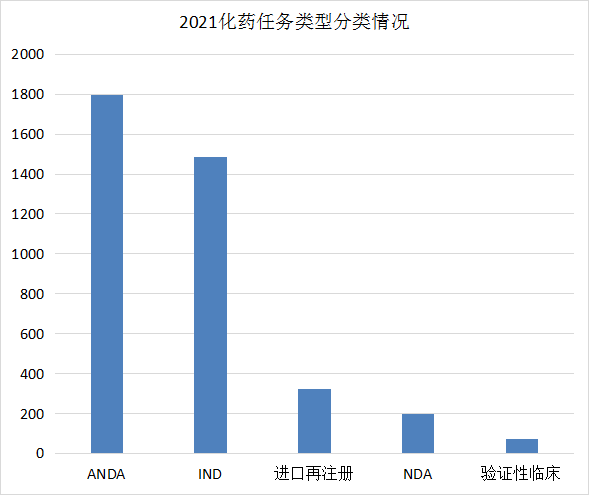
图11 2021年化药任务类型分类情况
数据来源:药智数据、药智咨询整理
从化药申请类型看,补充申请还是占大部分,2021年化药补充申请注册申报受理3958个,占到了化药申报总量的48.42%。2021 年 CDE 化药各申请类型受理情况详见图12。
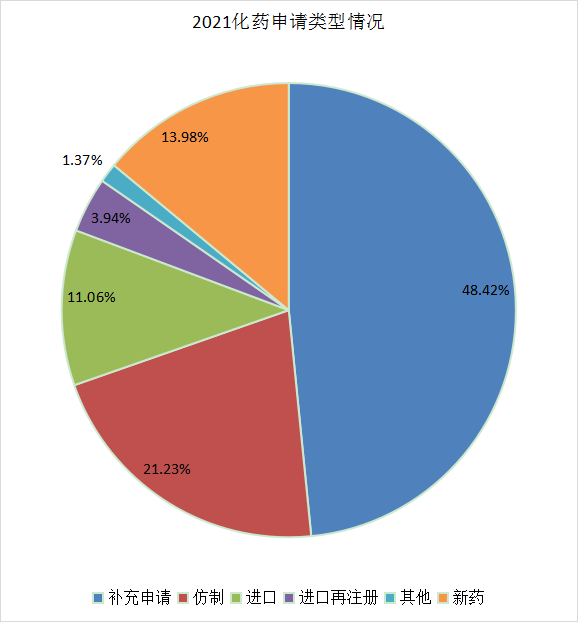
图12 2021化药申请类型情况
数据来源:药智数据、药智咨询整理
化药一致性评价申请数量为888个,视同通过一致性评价申请数量为2076个。
1.1 化药1 类新药申报情况
按现行化药注册分类,化药1类定义为:境内外均未上市的创新药,包含含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2021年化药1类新药申报受理号合计1457个,其中补充申请297个,国产1类新药注册申请896个,进口1类注册申请264个,详情见图13。
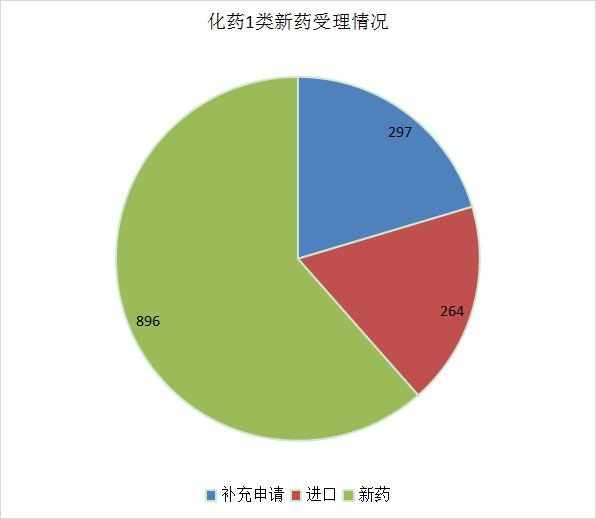
图13 2021年1类新药申请情况分布图
数据来源:药智数据、药智咨询整理
1.2 化药1 类新药(国产)、进口申报情况
1457个1类化学药创新药注册申请中以国产化学创新药为主,国产化学药创新药注册申请以受理号计有896个,其中IND申请866个,NDA申请27个;进口化学药创新药注册申请以受理号计有264个,其中IND申请257个,NDA申请7个;化学药创新药注册申请补充申请以受理号计有297个,其中国产化学药创新药注册补充申请196个,进口化学药创新药注册补充申请101个。2021年化药1类新药、进口注册申请受理情况详见图14,国产1类新药每月审评任务分类情况详见图15。
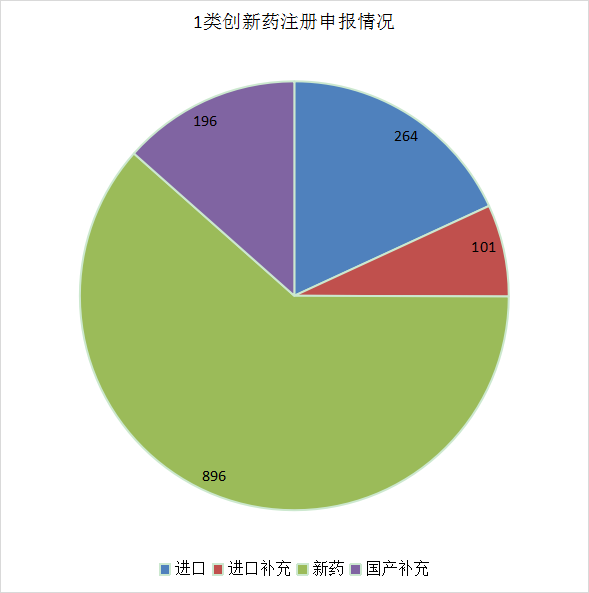
图14 2021年化药1类新药、进口注册申请受理情况
数据来源:药智数据、药智咨询整理
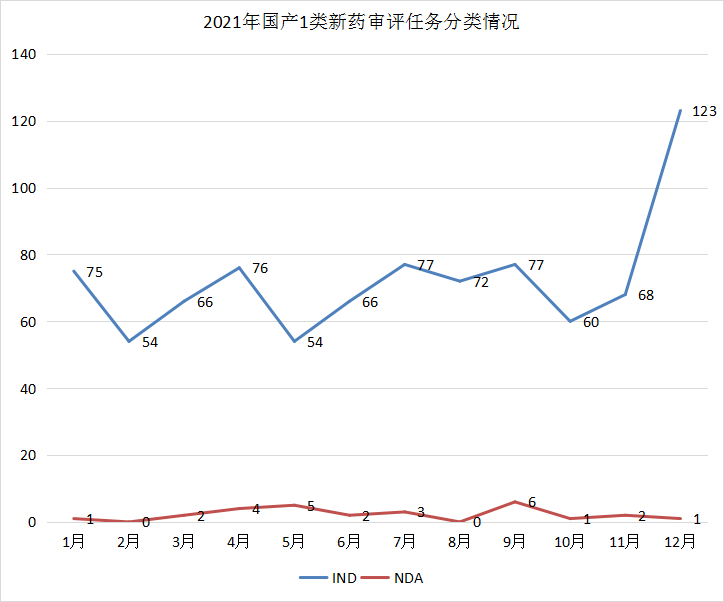
图15 2021年国产1类新药审评任务分类情况
数据来源:药智数据、药智咨询整理
1.3 一致性评价受理情况
随着一致性评价的持续进行,2021年与2020年同期CDE受理一致性评价补充受理数量一致,2021年为890个,2020年为898个,基本一致,2021年受理的一致性评价申请总体保持平稳状态,不如2020年波动大。2021年一致性评价受理情况和2020年对比情况见图16。
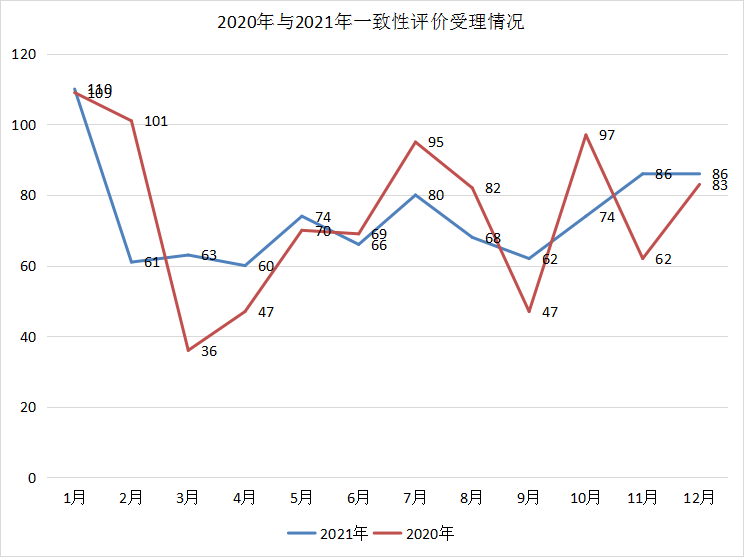
图16 2020年与2021年一致性评价受理情况
数据来源:药智数据、药智咨询整理
2.2021年化药审评完结情况
2021年(注:办理日期(药智)从2021年1月1日至2021年12月31日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的化学药注册申请7875个,其中补充申请3939个,新药1008个,进口813个。2021年化药各申请类型完成审评情况详见图17。
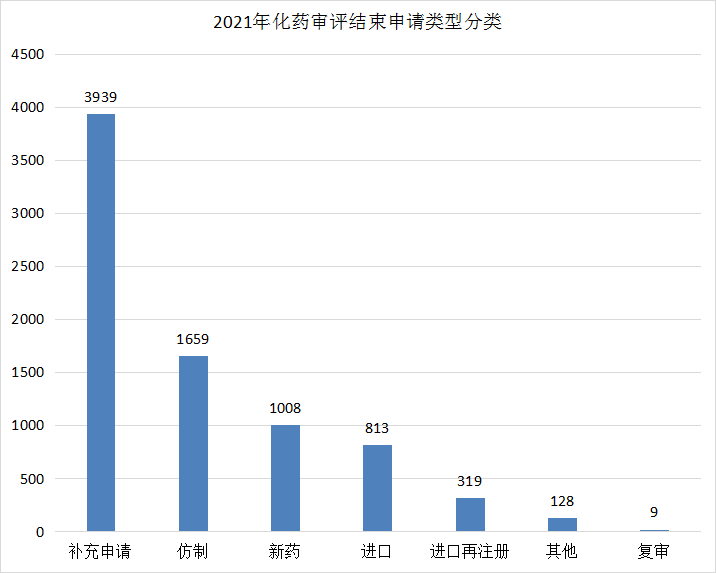
图17 2021年化药各申请类型完成审评情况
数据来源:药智数据、药智咨询整理
2021年审评结论仍以批准补充为主,具体结论请查询药智网药品注册与受理数据库。2021 年化药审评结论情况详见图18。
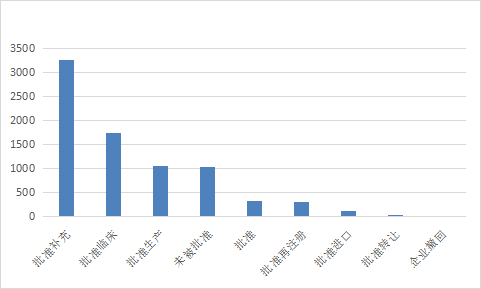
图 18 2021 年化药审评结论情况
数据来源:药智数据、药智咨询整理
注:统计时间为 2022年 01月11日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
/ 03 /
中 药
1.中药申报情况
2021 年CDE共承办新的中药注册申请以受理号计有1371个。中药受自身药品特性的影响,一直以来申报都处于比较低迷的状态,但2021年中药申报数量显著提升,接近2020年申报数量的3倍。2021年新药申请62个,其中52个IND申请和10个NDA申请;补充申请仍旧占据中药受理的大半江山,受理1297个,2021 年 CDE 中药各申请类型受理情况详见图19。
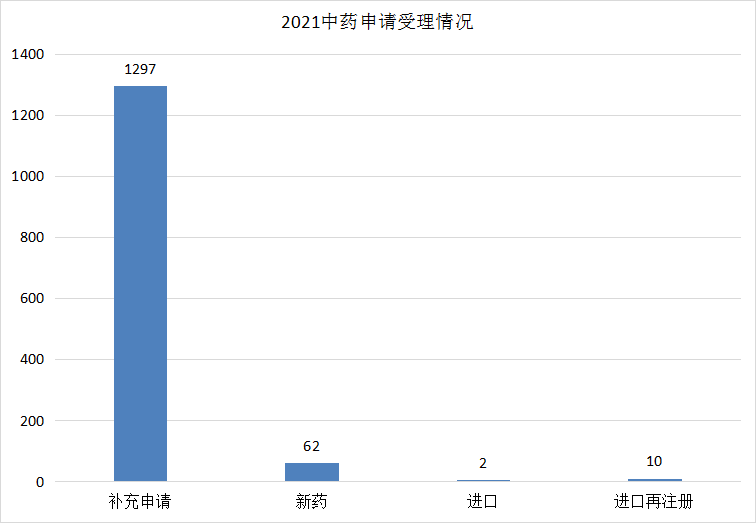
图19 2021年中药受理分布情况
数据来源:药智数据、药智咨询整理
2.中药注册申请审评完成情况
2021年(注:状态日期(药智)从2021年1月1日至2021年12月31日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的中药注册申请1316个,其中批准补充1106个,批准临床44个(新药IND申请34个,申请补充10个),批准转让43个,未被批准86个。2021年中药申请审评完成情况见图20。
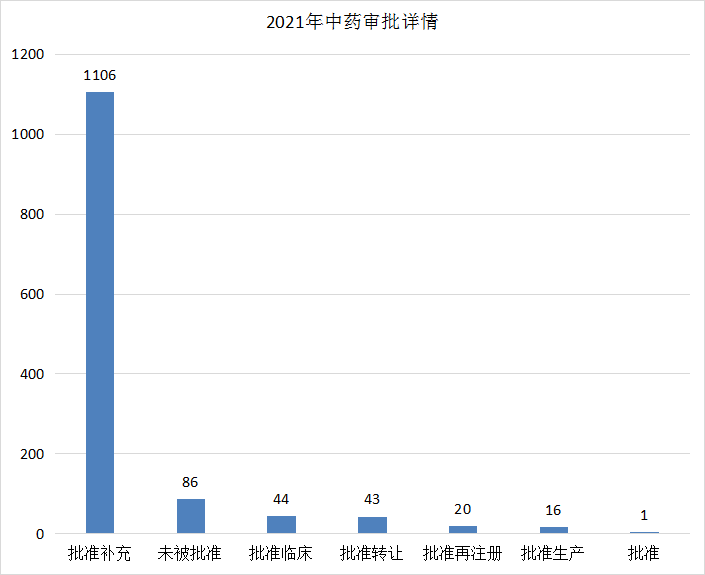
图 20 2021年中药申请审评完成情况
数据来源:药智数据、药智咨询整理
注:统计时间为 2022年 01月 11日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
/ 03 /
生 物 制 品
1.生物制品申报情况
2021年CDE共承办新的生物制品注册申请以受理号计有2022个。和2020年受理数量每月逐渐上升相比,2021年每月承办数量基本保持平稳状态。2021年每月 CDE 生物制品受理情况和2020年同期受理情况详见图21。
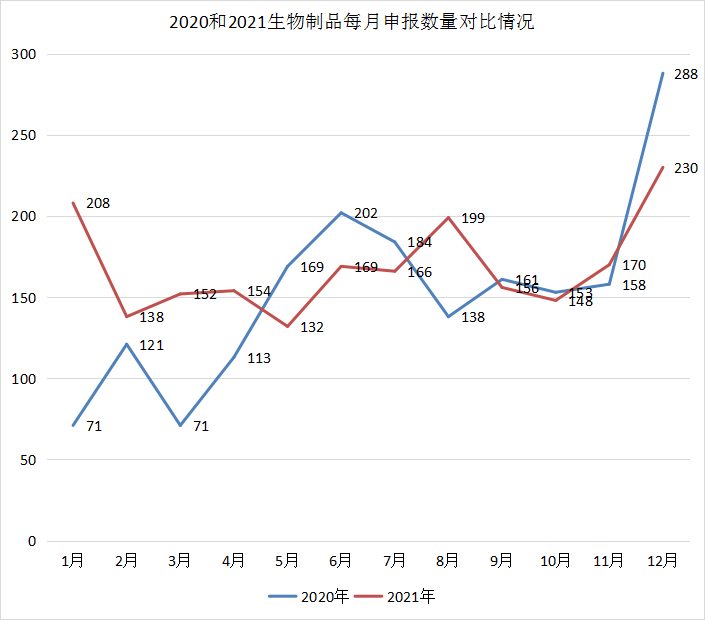
图21 2020和2021生物制品每月申报数量对比情况
数据来源:药智数据、药智咨询整理
2021年CDE受理生物制品注册申请2022件(主要为治疗用生物制品申请受理),其中受理生物制品临床试验申请822件(预防用生物制品27件,治疗用生物制品795件),受理生物制品补充申请896件(预防用生物制品128件,治疗用生物制品768件),受理生物制品上市申请162件(预防用生物制品8件,治疗用生物制品154件)。2021年生物制品各类注册申请受理情况详见图22。
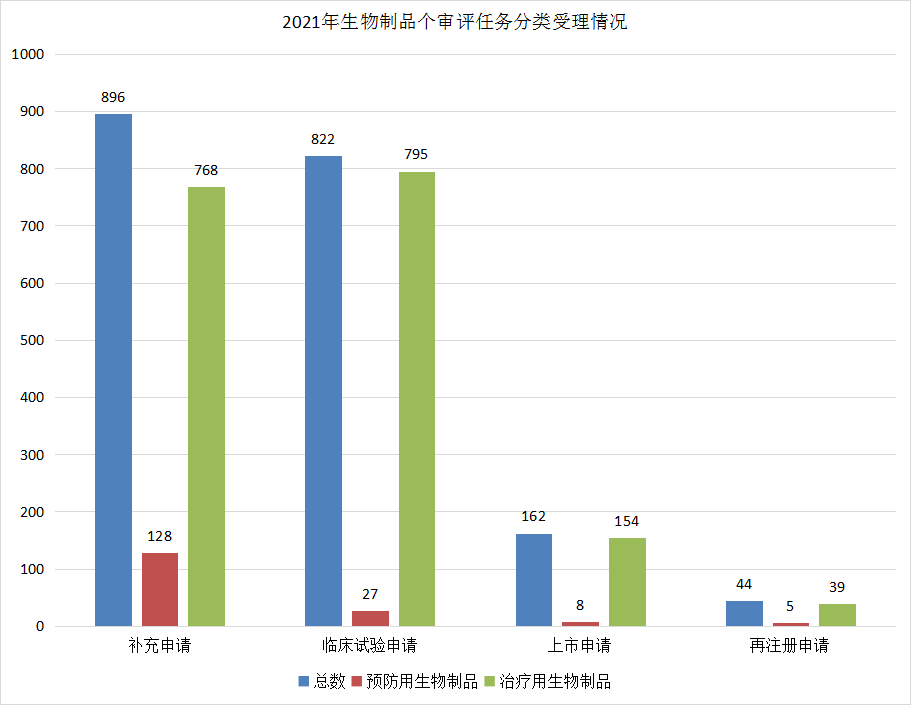
图 22 2021年生物制品各审评任务分类申请受理情况
数据来源:药智数据、药智咨询整理
2.1类生物制品创新药受理情况
CDE受理1类生物制品创新药注册申请744个,较去年全年336个有明显大幅上升,其中预防用生物制品10个,治疗用生物制品734个。申报数量具体情况见图23。
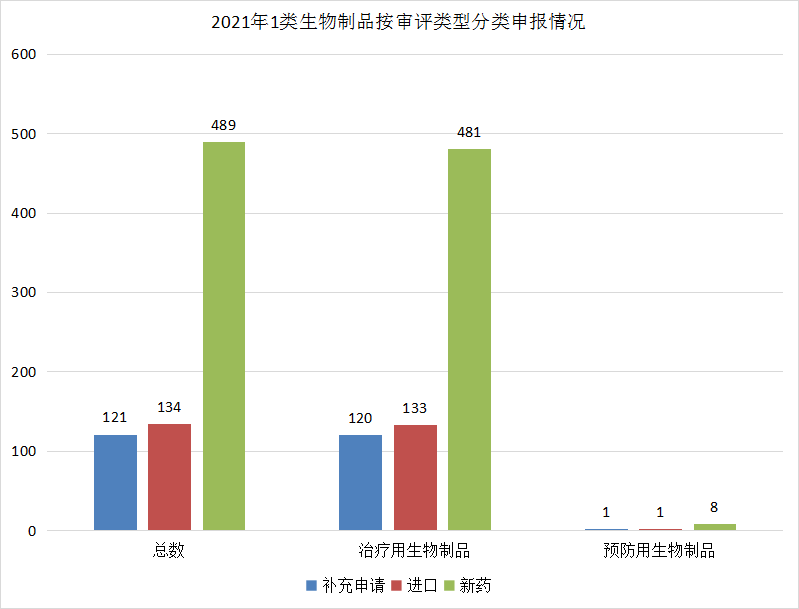
图23 2021年1类生物制品按审评类型分类申报情况
数据来源:药智数据、药智咨询整理
1类生物制品创新药注册申请中,临床试验申请606个(预防用生物制品9个),上市申请16个(治疗用生物制品)。具体情况见图24。
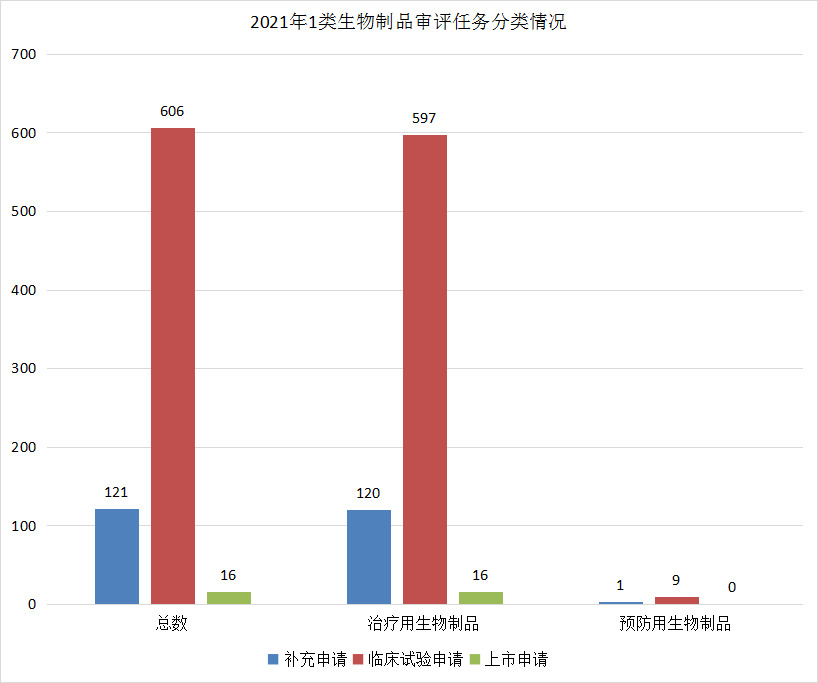
图24 2021年1类生物制品审评任务分类情况
数据来源:药智数据、药智咨询整理
3.生物制品注册申请审评完成情况
2021年(注:状态日期(药智)从2021年1月1日至2021年12月31日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的生物制品注册申请共1832个,其中完成临床申请的930个(预防用生物制品36个,治疗用生物制品894个),补充申请的556个(预防用生物制品106个,治疗用生物制品444个)。2021年生物制品审评完成情况详见图25.
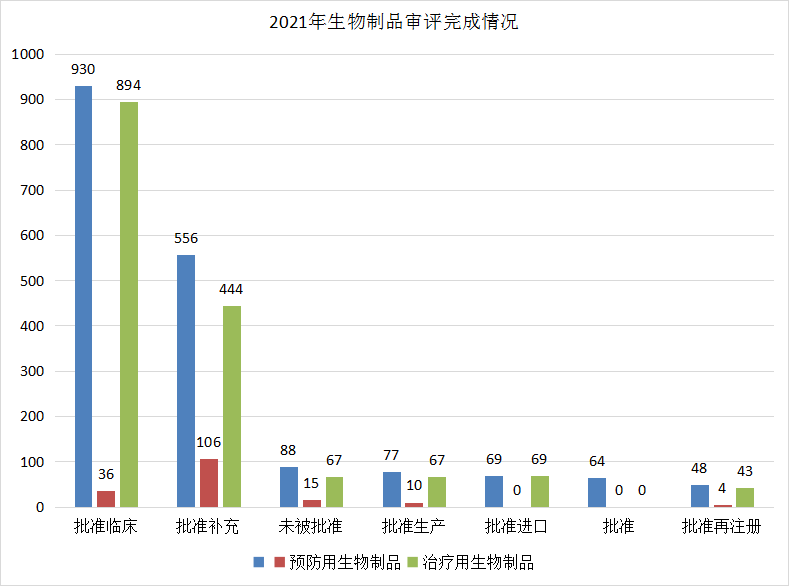
图 25 2021年生物制品审评完成情况
数据来源:药智数据、药智咨询整理
注:统计时间为 2022年01月 11日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
/ 04 /
优先审评品种纳入情况
2021年CDE将97个受理号注册申请纳入优先审评程序,其中化药57个,生物制品38个,中药2个;纳入理由包含符合附条件批准的药品35个,儿童用药26个、其他优先审评审批情形17个,纳入突破性治疗药物程序11个;适应症包括特发性矮小症、银屑病、癌症等多个领域。具体情况见表1 。
表1 2021年受理并纳入优先审评序列受理号情况

/ 05 /
突破性治疗品种纳入情况
申请适用突破性治疗药物程序条件:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
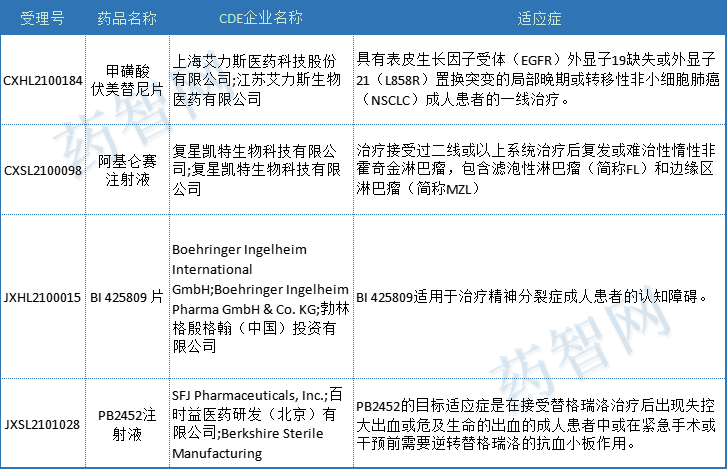
2021年CDE将4个承办日期在2021-01-01之后受理的受理号纳入到突破性治疗程序中;具体情况见表2。详细内容请查看药智网药品注册与受理数据库。
表2 2021年受理并纳入突破性治疗程序受理号情况
数据来源:药智药品注册与受理数据库

责任编辑:琉璃
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。




• 吸入剂大品种多家企业过评!齐鲁拿下一款微乳制剂首仿,普利制药、东北制药…
• 62个品种过评,12个品种首家过评!海南通用三洋、扬子江、华海...
• 深度盘点:重庆药品申报数量大增!药友制药、复创医药、圣华曦…
• 深度盘点:2021年CDE受理1439个国产1类创新药注册申请,中药申报数量创新高!
• 数十款国产1类新药申报临床,两款单抗提交上市申请,先声药业、乐普生物、恩华…
• 70余款1类新药获受理,13款新药提交上市申请,齐鲁制药、康方生物、恒瑞…
• 8月CDE药审分析,73个化药1类新药获受理,生物药新药申报数量再创新高,恒瑞、信达…
• CDE药审分析,新增46个1类治疗用生物制品受理号,80个化药1类品种,和黄医药、齐鲁…
• 干货!2021上半年CDE药品审评情况分析报告
• CDE药审分析,30个1类治疗用生物制品,46个化药1类品种获受理,歌礼、豪森....
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



