从PARP 抑制剂看卵巢癌药物研发历程
卵巢癌是一种妇女常见癌症,也是女性因癌症死亡的第五大常见原因,用药市场广阔,并有逐年上升的趋势。目前已获批上市和进行3期临床的卵巢癌治疗药物分别如表1、2所示。
表1已上市的卵巢癌治疗药物
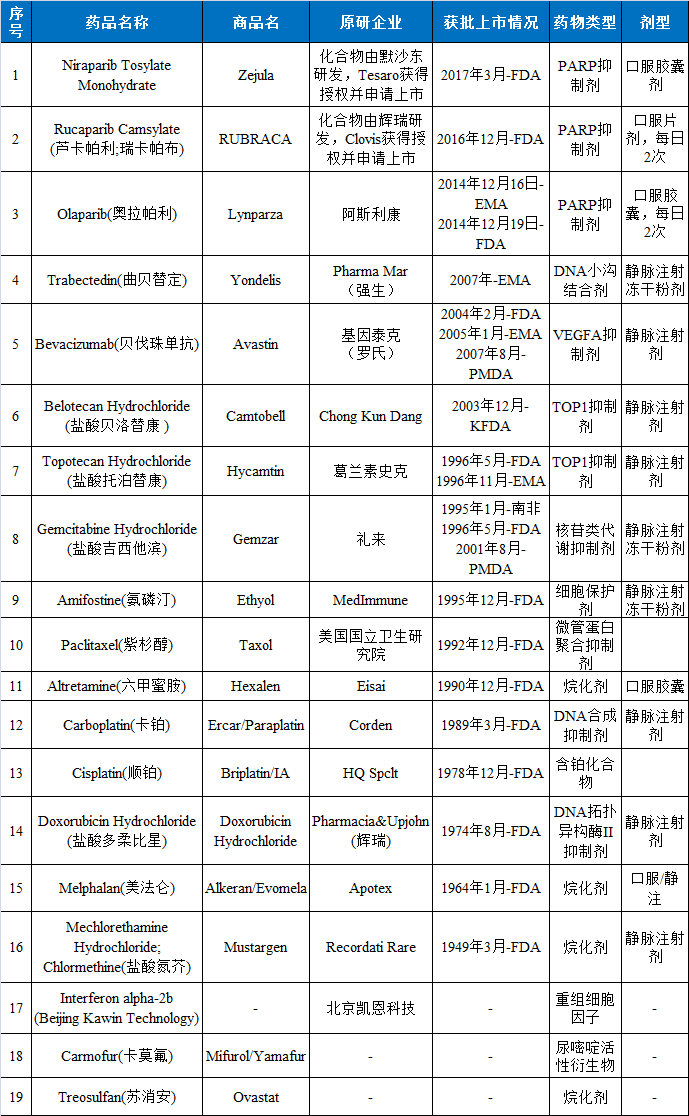
表2正在进行3期临床的卵巢癌治疗药物
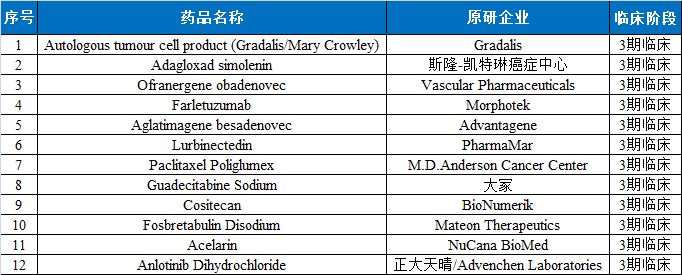
卵巢癌治疗药物研发历程
卵巢癌药物治疗的研发从单药烷化剂开始,其后依次为非顺铂联合化疗、顺铂、新细胞毒药物紫杉醇(20世纪90年代初紫杉醇被广泛用于治疗复发耐药的卵巢癌)。在这之后,抗癌新药开始不断涌现,主要有拓朴替康、吉西他滨、口服依托泊苷胶囊、多西他滨、多柔比星脂质体、奥沙利铂等等,其中以拓朴替康应用最多。近年来,随着生物学治疗和小分子靶向治疗技术的进步,贝伐单抗、曲贝替定、人参皂苷和铂类升级产品奈达铂等陆续获批上市,并获得了更可靠的疗效和安全性证明,直至二十一世纪的今天,PARP抑制剂获批上市。
日前,美国FDA批准了Tesaro用于复发性上皮卵巢癌、输卵管癌或原发性腹膜癌女性患者的维持治疗药物Zejula(Niraparib)的上市申请。这是美国FDA批准的首个无需BRCA突变或其他生物标志物检测就可用于治疗的口服PARP抑制剂(结构式如图1所示),曾获得美国FDA颁发的快速通道资格、突破性疗法认定以及优先审评资格。预计Niraparib将于本月正式进入美国市场。
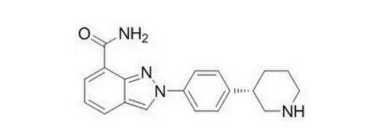
图1Niraparib结构式
美国FDA批准上市的三个PARP抑制剂
PARP抑制剂是一种靶向聚ADP核糖聚合酶(PolyADP-ribosePolymerase)的癌症疗法,也是第一种成功利用合成致死(SyntheticLethality)概念获得批准在临床使用的抗癌药物。简单看一下原理:合成致死指当两种不同的基因或蛋白同时发生变化时会导致细胞死亡,而这两种基因/蛋白中如果只有一种异常则不会导致细胞死亡。携带BRCA1/2种系基因突变的癌症患者体内的肿瘤携带着特定的DNA修复缺陷,因此对同样能阻碍DNA修复的PARP抑制剂敏感。
截至目前,共有3个PARP抑制剂获批上市(如表3所示),分别为阿斯利康的Lynparza、Clovis的Rubraca以及Tesaro的Zejula,批准用于BRCA变异复发卵巢癌的治疗。Zejula的特别之处在于它是首个用于维持疗法的PARP抑制剂,即用于维持处于应答阶段的病人,且没有BRCA变异限制,所以适用人群大于前两个PARP抑制剂。
阿斯利康的Lynparza于2014年末上市,2015和2016年的全球销售额分别为0.94亿美元和2.18亿美元,销售额增长迅速(增长131.9%),卵巢癌市场远未饱和。Clovis的Rubraca于2016年末获批上市,只比Tesaro的Zejula早了3个月获批上市。
表3三个获批上市的PARP抑制剂

Zejula化合物由默沙东研发,之后授权给了Tesaro,Tesaro紧接着又授权给了再鼎医药和杨森制药。
今年3月份,CFDA已经受理了再鼎医药提交的临床申请。Tesaro与再鼎医药达成战略合作,获得了Zejula在中国市场的研发和销售权,Tesaro保留了可能参与Zejula在中国共同销售的选择权。作为交换条件,Tesaro从再鼎医药获得了2个新型、处于研发阶段的免疫肿瘤新药项目海外合作的选择权。再鼎医药产品申报获批情况如表4所示,看完再鼎医药的申报品种,Tesaro选择与再鼎医药合作也是情有可原。
表4再鼎医药产品申报获批情况
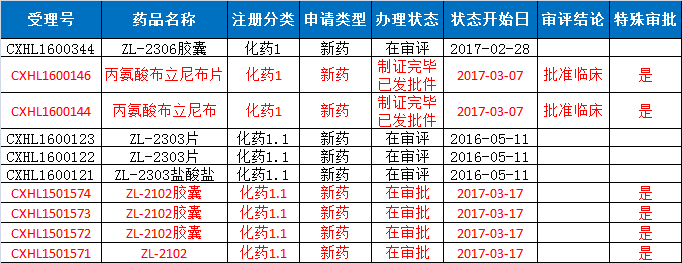
数据来源:药智数据
原创申明:本文系药智网原创稿件,欢迎转载,转载请注明来源,谢谢!

• 【中药榜】《2017中国中药研发实力排行榜TOP50》隆重揭晓!
• 【品牌榜】《2017中国药品研发品牌排行榜TOP50》隆重揭晓!
• CDE历年受理的特殊审批、重大专项、优先审评品种分析
• 兰索拉唑药物报告(lansoprazole Drug Report)
• 中药保护品种分析大全,那些你不知道的都在这儿!
• 浅析多肽药物领军企业----翰宇药业
• 2016年保健食品获批创新低 药企跨界这几点须重视!
• 甲磺酸伊马替尼药物报告(imatinib mesylate Drug Report)
• 从PARP 抑制剂看卵巢癌药物研发历程
• 【大事件】三月医药政策解析全看点
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938




