ICH“质量风险管理”在GMP管理过程中的应用
(本文主要参考资料来自ICH行业指南Q9质量风险管理)
<Guidance for Industry Q9 Quality Risk Management June 2006 ICH>
2009年在中国新版GMP草案中,我们欣喜地看到“质量风险管理(QRM)”概念的引入,这对药品整个生命周期进行质量风险的识别、评估、控制、沟通、回顾都具有重要作用,将能确保为患者提供高品质的产品。
2006版ICHQ9及2008版欧盟GMP指南附录20中均引用了“质量风险管理”的内容。随着GMP管理水平的不断提升,“质量风险管理”在GMP管理过程中必将得到越来越广泛的重视和应用。
本文将阐述质量风险管理流程、方法及其在药品生产质量管理过程中的应用案例。
一、“质量风险管理(QRM)”的定义及模式图
1.质量风险管理(Quality Risk Management)定义。
1.1 ICHQ9中关于QRM的定义:质量风险管理是质量管理方针、程序及规范在评估、控制、沟通和回顾风险时的系统应用。
1.2“风险(Risk)”由两个关键因素构成:
●危害发生的可能性;
●危害发生的严重性。
有效地管理风险就是对风险的这两个因素的控制。
1.3 QRM在药品行业应坚持如下三个主要原则:
●质量风险管理以科学性和技术性为依据,并以符合现行法律法规为前提条件;
●任何输出的结果或行动都应以保护患者的利益为出发点;
●质量风险管理流程和文件的复杂程度应与所对应的风险程度相一致。
1.4 QRM应用范围:
●确定并评估产品或流程偏差、产品投诉对质量和药政法规造成的潜在影响,包括对不同市场的影响;
●评估并确定内部、外部质量审计的范围;
●厂房设施、建筑材料、通用工程及预防性维护项目或计算机系统的新建或改造风险的评估;
●评估验证活动的范围和深度;
●评估质量体系,如材料、产品发放、标签或批审核效果或变化等
QRM广泛应用于GMP管理的各个领域。
2.质量风险管理模式图。
2.1 通常我们做决定的程序是:
●确定需采取行动的事件或确定发生了什么;
●收集相关数据和信息;
●分析并找出事件发生的原因;
●实施改进行动
如上过程是对已发生事件所采取的行动和预防措施,评估过程数据是回顾性的,即关注已出现偏差的原因分析及行动。
与之相对,质量风险管理(QRM)是通过掌握足够的知识、事实、数据后,前瞻性地推断未来可能会发生的事件,通过风险控制,避免危害发生。
其程序为:
●识别潜在风险
●分析潜在风险
●评估潜在风险
●控制潜在风险
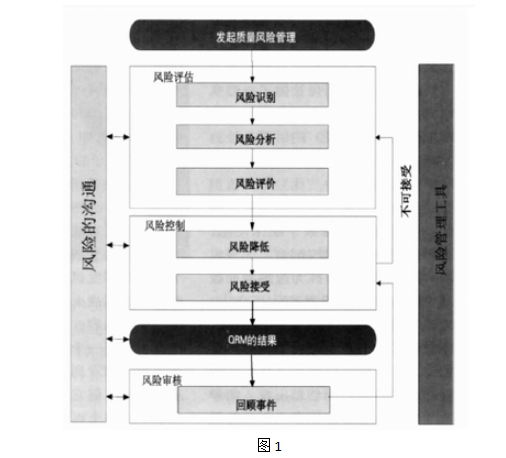
质量风险管理贯穿药品质量和生产管理的各个方面,包含多种方法和适应性。
二、质量风险管理步骤详细说明
1.确定事件并启动质量风险管理。
在最初阶段清楚地确定风险问题或事件对QRM结果的产生有很重要的影响。
通常需要考虑的风险包括对患者的风险;产品不符合标准要求的风险;法规不符合的风险等。
在此阶段还需收集背景信息并确定QRM项目小组人员及资源配置等。
2.风险评估。
a)风险识别
b)分析风险(定性或定量)
i.发生的可能性
ii.危害的严重性
iii.可测量性
c)风险评估
多数情况下,当我们要做出某决定时有很多的风险元素需要考虑或平衡,而且这些元素不受我们的控制,他们既具有危害的可能性也有危害的严重性,每个风险元素应经过评估以建立可能出现风险的预防措施。
用于风险识别的信息可以包括历史数据、理论分析、建议以及影响决策的相关联系事件等。
针对不同的风险项目需选择应用不同的分析工具。
3.风险控制。
a)风险降低:采取行动以降低或避免风险,包括采取行动降低风险的严重性或风险发生的可能性等。
风险降低的一些方法可能对系统引入新的风险或显著提高其他已存在的风险,此时风险评估必须重复进行以确定和评估风险的可能变化。
b)风险接受:建立风险可接受限度或水平。
风险降低的行动及风险可接受限度由许多参数决定,包括利益、风险、资源等,但均应以保护患者利益为核心。
4.风险沟通和文件。
一旦风险控制行动被确定,这些行动就应被记录为确定的工作流程。如:
●与偏差有关的风险控制行动应被记录,并与其他相关人员沟通结果。
●与验证有关的风险决定应记录在验证主计划或验证纲要中。
●所有风险管理的输出结果均应与相关人员进行有效的沟通并建立QRM文件存档。
5.定期回顾所建立的QRM结果。
QRM的决定或行动基于当时的条件下作出,QRM结果应根据新知识、新环境被更新,根据风险控制项目及水平确定回顾频率
三、质量风险评估工具的选择
针对不同的风险项目或数据可选择不同的风险评估工具或方法。
应用定性或定量的评估过程确定风险的可能性和严重性。风险评估的结果可以表示为总体的风险值,例如:定量的表示为具体的数字,如0到100;或定性的表示为风险的范围,如高,中,低。
介绍几种常用的风险评估工具:
1.一般的常用统计工具,用于收集或组织数据、构建项目管理等,包括:流程图、图形分析、鱼骨图、检查列表等。如:
帕雷托图模式
图2
这些技术分析数据可用于汇总数据、分析趋势等,以帮助完成不复杂的质量偏差、投诉、缺陷等的风险管理。
2.风险排列和过滤(Risk Ranking and Filtering:RRF)。
这个方法是将风险因素进行排列和比较,对每种风险因素做多重的定量和定性的评价,权衡因素并确定风险得分。
风险评价可以使用“低/中/高”或“1/2/3”的分类和简单的矩阵。
矩阵图
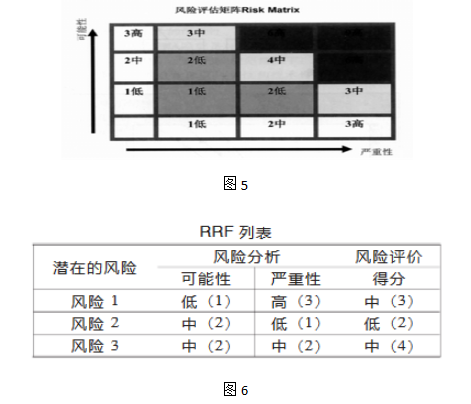
RRF适用于对事件定性及定量的全面分析。
3.事先危害分析(Preliminary Hazard:Analysis PHA)。
PHA用于在事情发生前应用经验和知识对危害和失败进行分析,以确定将来可能发生的危害或失败。
这个方法基于在给定的条件下对风险矩阵的开发,包括:
■严重性的定义和排列:严重,主要,次要,可忽略;
■发生频次(可能性)的定义和排列:频繁,可能,偶尔,罕见;
■风险的水平和定义:
高:此风险必须降低;
中:此风险必须适当地降低至尽可能低;
低:考虑收益和支出,降低至尽可能低;
微小:通常可以接受的风险
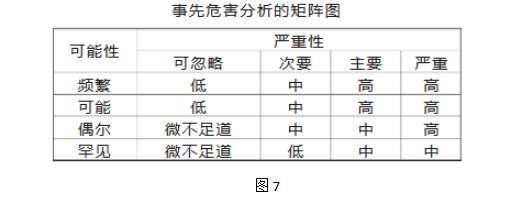
PHA常用于评估产品、过程、厂房设施等前期设计阶段所存在的潜在缺陷
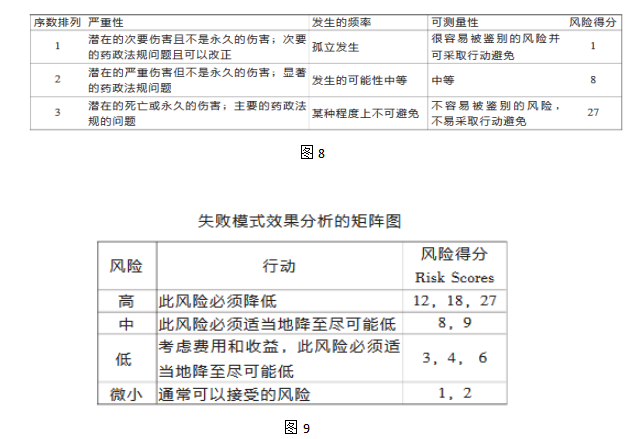
4.失败模式效果分析
评估潜在的失败模式和因此对产品性能或结果产生的影响。
一旦失败模式被确定,可应用风险降低来消除、减少或控制潜在的失败。
FMEA工具依赖于对产品和流程的深入了解,针对每种失败模式确定相应的风险得分。
FMEA排列标准和失败得分举例(见表)
严重性×可能性×可测定性=风险得分
5.危害分析及主要控制点(Hazard Analysis and Critical Control Points: HACCP)。
HACCP共有7步,该工具的应用需基于对过程或产品有深刻的理解。
a)列出过程每一步的潜在危害,进行危害分析和控制;
b)确定主要控制点(CCP);
c)对主要控制点建立可接受限度;
d)对主要控制点建立监测系统;
e)确定出现偏差时的正确行动;
f)建立系统以确定HACCP被有效执行;
g)确定所建立的系统被持续维持。
HACCP用于产品的物理、化学性质等危害分析,只有对产品及过程有全面的了解和认识时方可正确地确定控制点,其输出结果可推广用于不同的产品生命周期阶段。
6.过失树分析(Fault Tree Analysis:FTA)。FAT是鉴别假设可能会发生过失的原因分析方法。FAT结合过失产生原因的多种可能假设,基于对过程的认识做出正确的判断。
基本图形

FTA用于建立发现过失产生原因的路径,是评估复杂过程中多种因素分析的有效工具。
四、质量风险管理案例
案例:应用质量风险管理的方法确定仪器设备校验周期
步骤 1风险识别
确定风险问题:根据仪器设备的情况,如何确定仪器设备的校验周期?
收集信息:历史校验记录;当前的校验周期;偏差报告等相关信息;是否对发放的产品产生影响等。
步骤 2风险分析
选择风险评估工具
本案例应用失败模式效果分析(FMEA),识别潜在的失败模式,对风险发生的频率、严重性和可测量性评分(见表I、表II、表III)。
表I:仪器设备校验失败的发生频率


步骤3 风险评估识别、分析和评价潜在的风险。
从发生频率、严重性和可测量性的角度出发确定仪器设备校验失败的影响:依据前述表I-III的各项标准综合、分解各项与之相关的参数。
表IV:质量风险评估案例
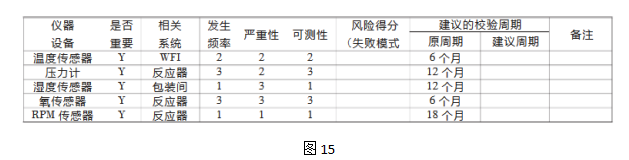
表V:失败模式效果分析的等级标准和失败赋值应用三分制的失败模式效果分析的等级标准和失败赋值。

分别用将低、中、高风险赋值以数字1、2、3。每一项标准(发生频率、严重性、可测量性)就会有一个对应的数字作为风险得分。失败风险得分为各项标准得分的乘积。如:
发生频率×严重性×可测量性=风险得分
步骤4 风险降低
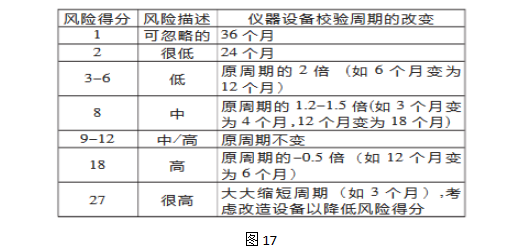
步骤5 风险接受
仪器设备校验失败的发生濒率、严重性和可测量性都分别评估完成并且达成一致,即可以定义风险可接受的标准。
使用失败模式效果分析(FMEA)的标准认定风险的等级并完成风险综合评估。
步骤6 风险沟通和审核
●文件和批准:更新设备校验规程并获得批准。
●沟通:完成相关人员的讨论及培训。
●新周期的风险审核:设备校验过程及使用过程中监控任何的偏差,如果出现偏差或增加设备校验的新条件或要求需重新评估。
随着全球制药行业GMP管理水平的不断提高及管理范围的不断深入,管理的科学性、技术性及前瞻性成为药品生产企业管理人员的重要课程。新版GMP的颁发,将标志着中国医药管理事业进入一个新的阶段,在此过程中,质量风险管理等科学监管工具的广泛应用将发挥其重要的作用。

原创申明:本文系药智网原创稿件,欢迎转载,转载请注明来源,谢谢!

合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





