多个首款产品,有望获批上市
近期,国家药品监督管理局医疗器械标准管理中心发布了《2025年第一次医疗器械产品分类界定结果汇总》文件,在该文件中涵盖了#168个体外诊断试剂产品的分类界定结果,部分产品被检测物质已经有相关的体外诊断检测产品上市,而还有部分检测物质是首次出现,现在针对Ⅱ、Ⅲ类的试剂未出现过的被检测物质进行筛选。
据悉,#器械分类界定 一般是企业无法依据现有的分类目录对新注册的产品进行分类,申请企业向药监部门提出产品分类的需求,国家药品监督管理局医疗器械标准管理中心会定期公示这类相关信息。
从下图可以看到,此次公示的文件中,被检测物质主要分布在其它生化免疫类,基因、蛋白和肿瘤检测相关的产品。目前在国内上市体外诊断试剂中,Ⅱ、Ⅲ类体外诊断试剂产品约四万六千多个注册证,被检测物质数量较多的是蛋白质、其它生化免疫类、酶类和激素类。一般常规的物质会被分类到具体的类别,而新增未被分类的则会被分类到其它生化免疫类。当前体外诊断试剂生产企业接近二千家,因此很多同质化的产品上市,使得市场的竞争异常激烈,发掘新的临床需求是企业开辟市场的一个有效突破口。
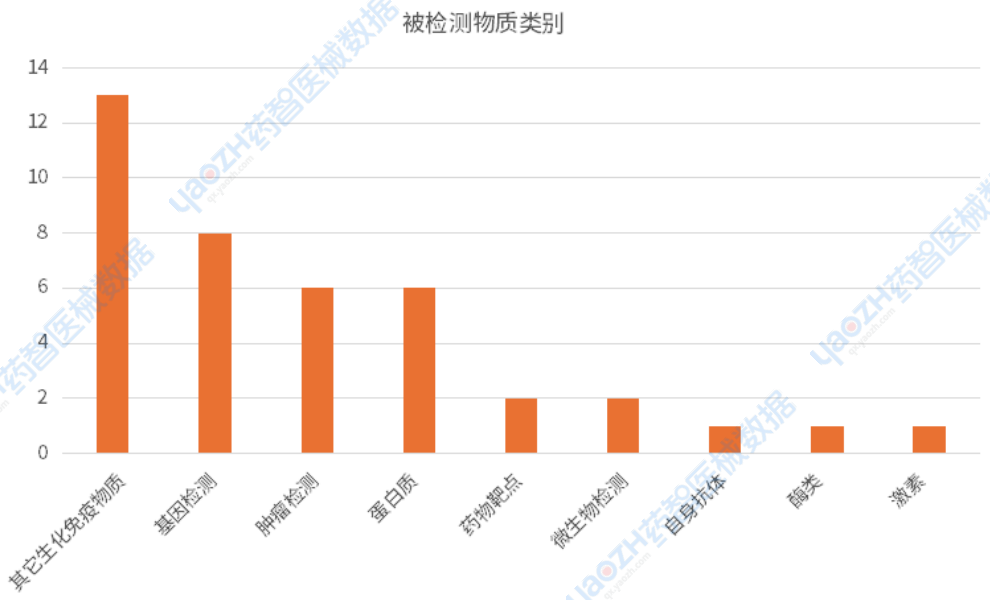
资料来源:医疗器械标准管理中心官网、药智医械数据
从下表可以看到这些新出现的Ⅱ类诊断试剂产品的被检测物质所对应的适应症主要有:眼部免疫、炎症,阿尔茨海默症,尿结石,脓毒症,慢加急性肝衰竭,自身免疫性郎飞结病,细菌感染性疾病及脓血症,血栓性疾病,龋齿,白塞病。
Ⅱ类首款诊断试剂产品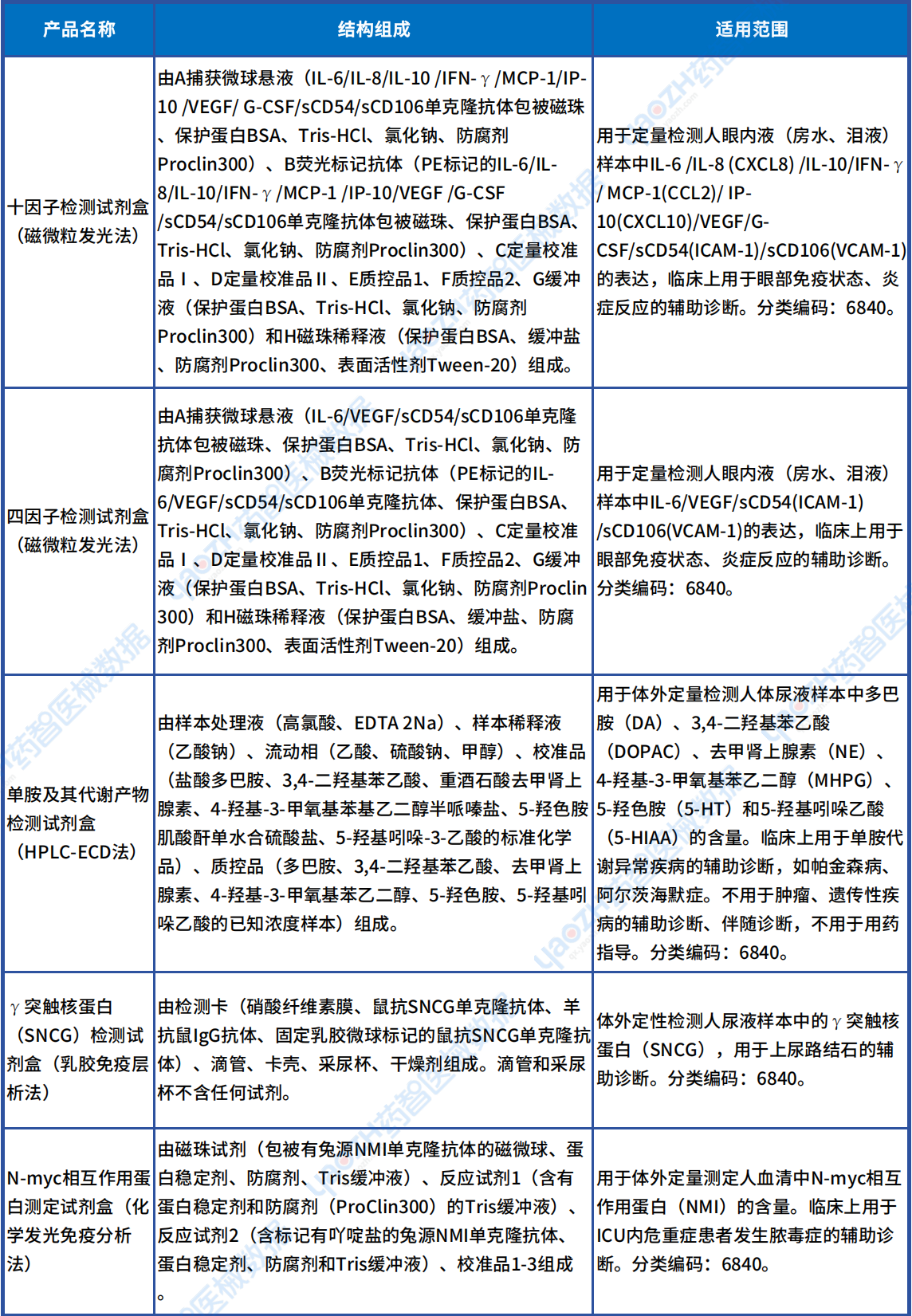
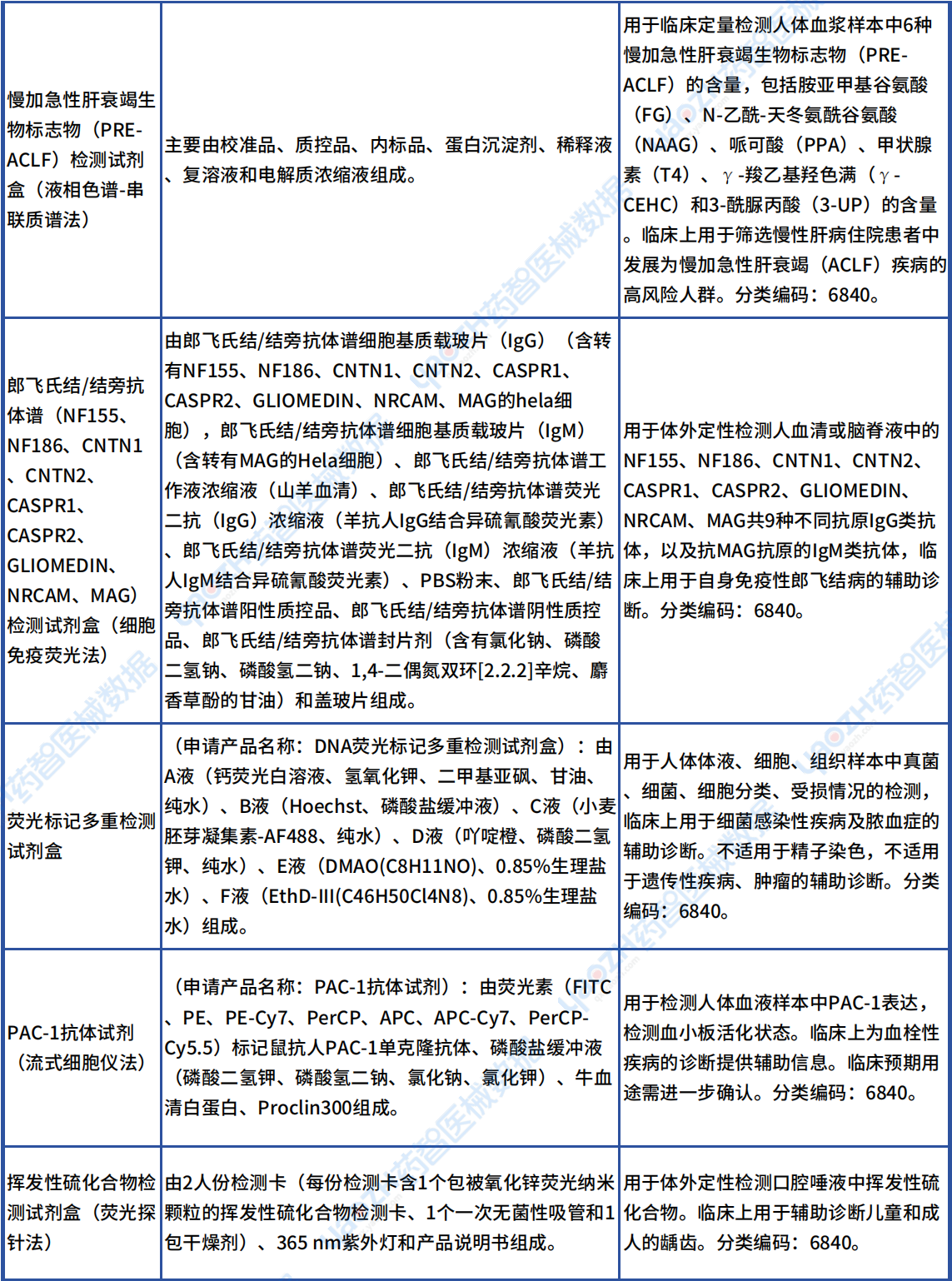

资料来源:医疗器械标准管理中心官网
从下表可以看出,Ⅲ类新出现的检测试剂中有不少是基因检测,主要用于肿瘤以及靶点的检测,这些检测针对的疾病有:B细胞急性淋巴细胞白血病、急性髓系白血病、神经母细胞瘤和髓母细胞瘤等,详情如下。
Ⅲ类首款诊断试剂产品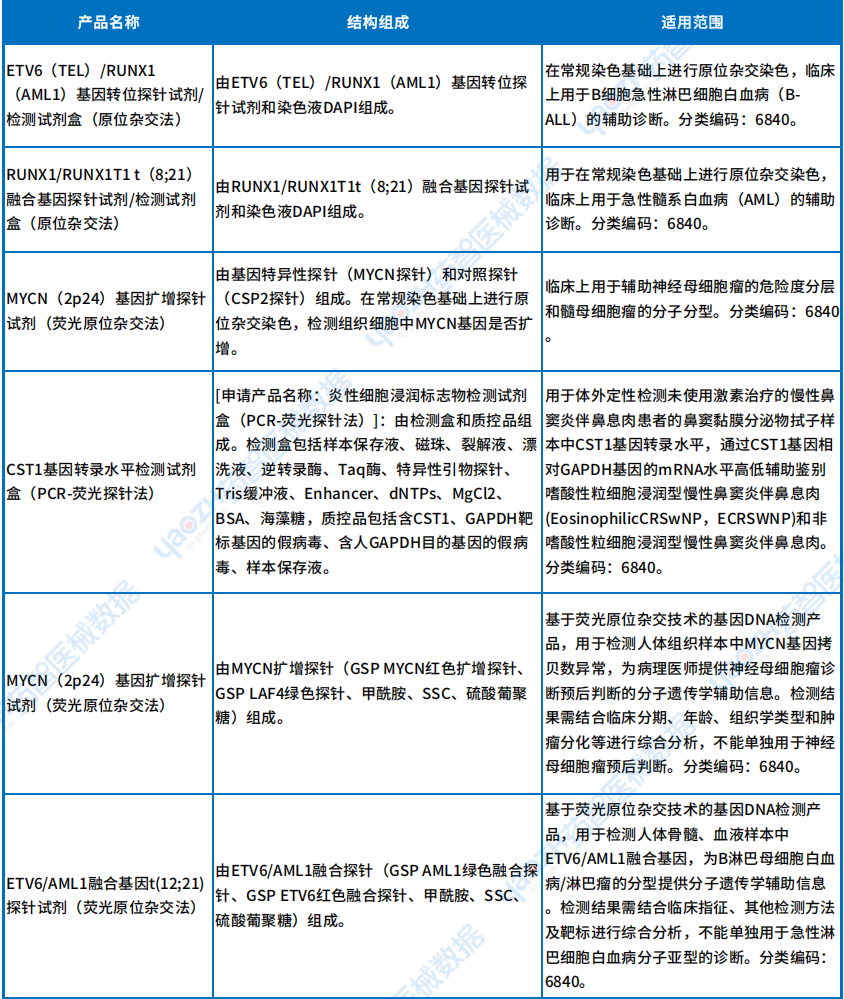
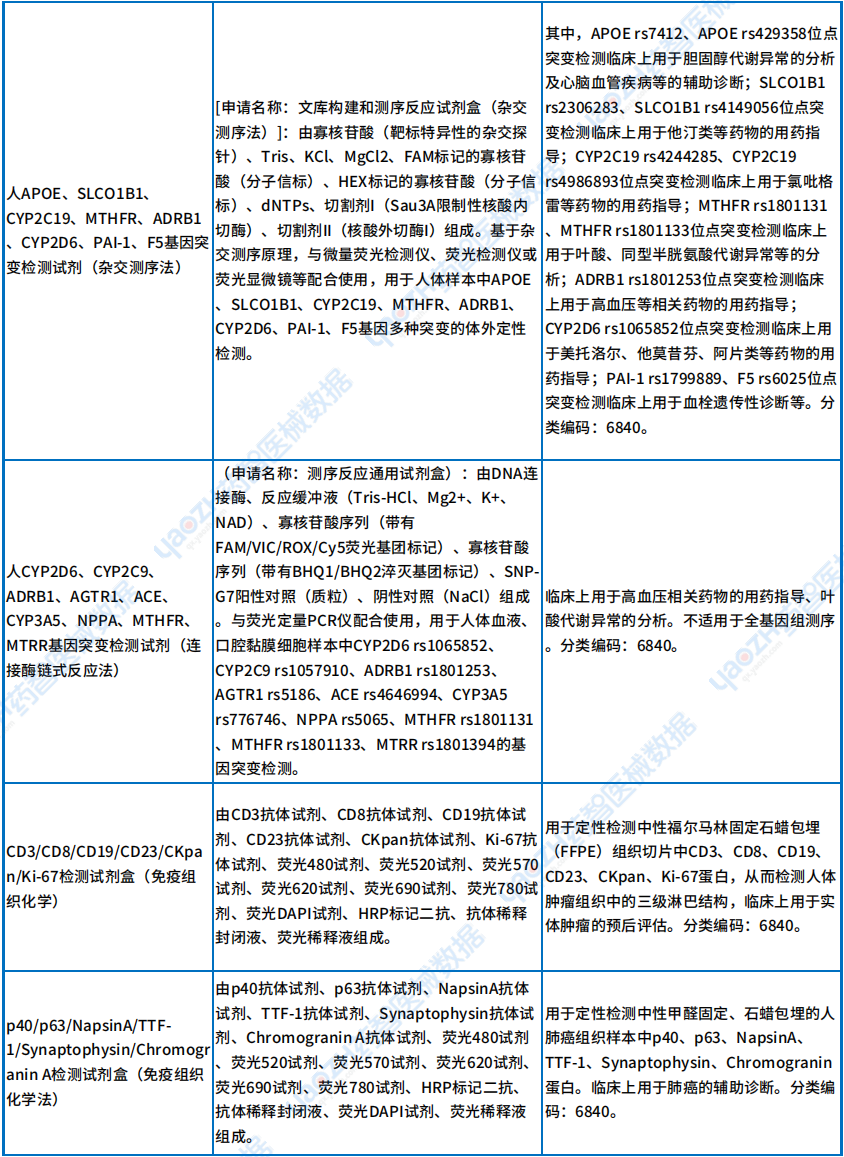
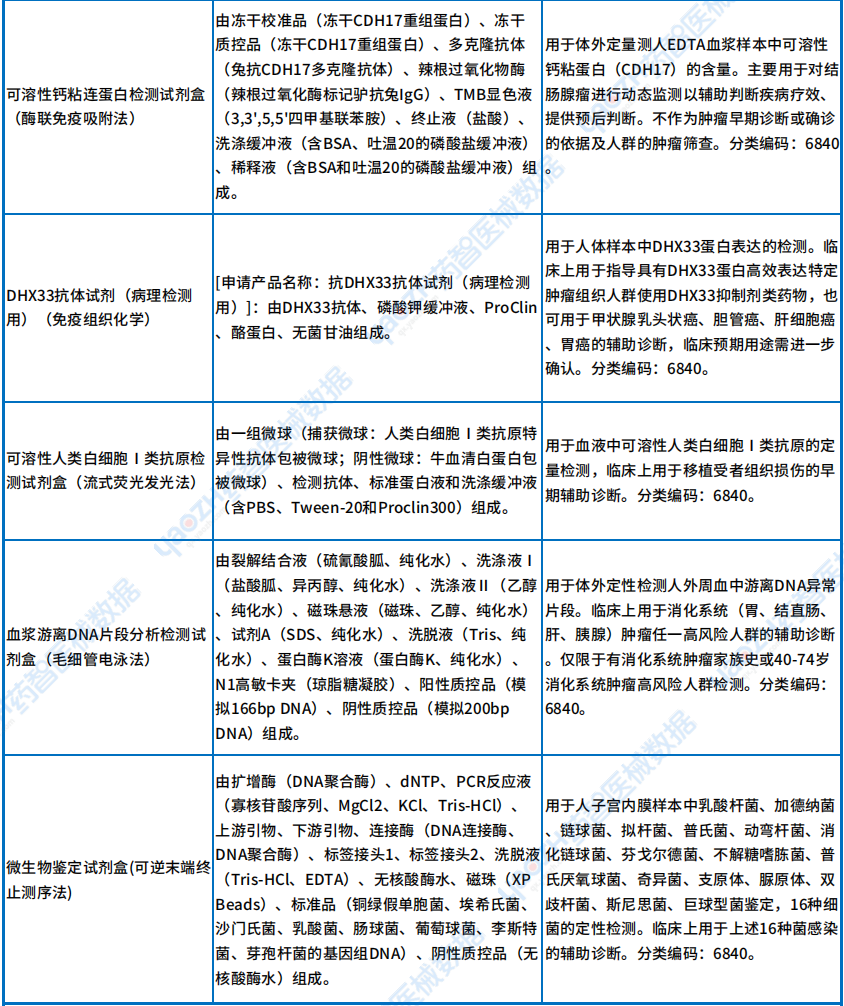
资料来源:医疗器械标准管理中心官网
值得注意的是,企业申请器械产品的分类界定有的是在立项阶段,有的在递交申请资料前。最终有的产品可能没有完成开发,有的可能因为开发不完善导致注册失败。
因此分类界定信息与产品上市之间还存在一定的不确定性。依据药智医械对近一年多的Ⅲ类体外诊断试剂申报注册耗时的统计,约70%的产品在1年左右可以获批,如果是更低风险的Ⅱ类产品的注册时间应该更短。上述产品能否最终获批上市,有待时间检验。
药智医械数据是全球医疗器械大数据解决方案服务商。依托药智网大数据服务平台,药智医械数据打造了涵盖医疗设备、耗材、IVD等在内的上百个专业数据库,累积亿级数据资源。形成了医疗器械研发注册、上市产品、市场数据、产品服务、企业/机构、法规标准等全产业链、全生命周期数据库集群。为用户提供权威、专业化数据查询与定制咨询服务。

对于医疗器械研发注册,药智医械数据可提供流行病学、临床诊疗指南、专利、文献等产品设计开发所需信息,说明书、性能指标等注册资料查询与下载,以及临床试验、注册进度、政策法规、各类标准等多方面的医疗器械信息查询与分析功能。可帮助医疗器械企业高效搜集资料,实现精准分析,规避潜在风险,加快研发注册进度。欢迎扫码或阅读原文预约药智医械数据免费试用体验。



责任编辑:木棉
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。

合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





