CRP检测试剂产品分析报告
据国家卫健委《2022年我国卫生健康事业发展统计公报》显示,2022年全国医疗卫生机构总诊疗人次达84.2亿人次,居民平均到医疗卫生机构就诊6.0次。随着人民健康需求日益增长,相关检测试剂需求量进一步提高。与此同时,由于抗生素使用受到了一定限制,各类细菌或病毒感染检测试剂实现大幅放量,相关产品市场规模迅速扩张。
CRP作为重要的检测项目,其相关检测试剂现状如何?
一、产品概述
C反应蛋白(CRP)是一种独特的蛋白质,肝脏受到白细胞介素6(IL-6)等炎症细胞因子的刺激时会生成该物质。CRP被认为是急性期反应物,在组织受损、感染初发或其他炎症原因出现后的数小时内,其水平会有所上升。CRP能够与补体系统相互协作,补体系统是机体免疫防御机制的重要组成部分。
通过检测C反应蛋白的含量,能够判断个体是否存在与急性感染或炎症相关的问题。
资料来源:药智医械数据
二、产品注册
2.1总体趋势
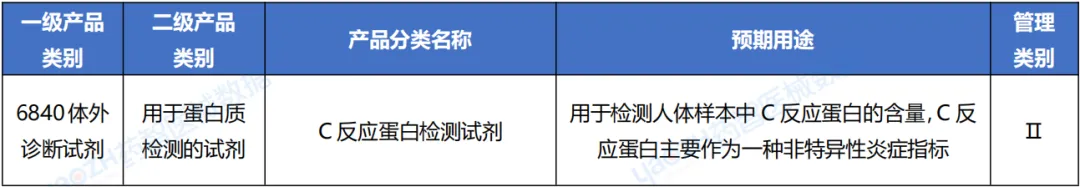
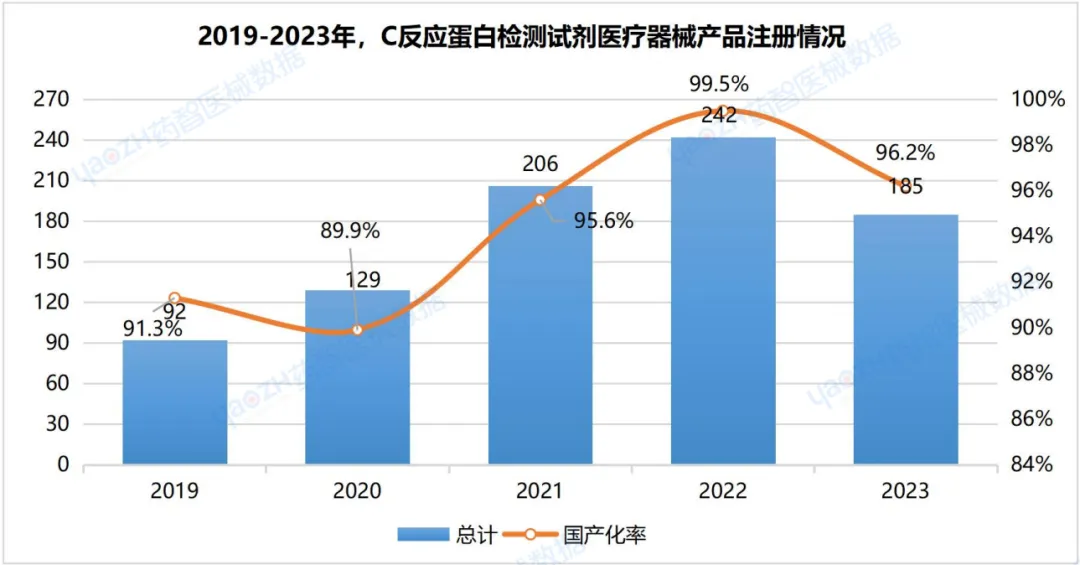
截至2024年3月,C反应蛋白检测试剂类医疗器械产品在有效期内产品注册总数为879件,五年平均国产化率达到94%左右。2019-2022年注册数量总体呈上升趋势,2023产品注册数量有所减少,2024年截至3月共19项产品注册。
数据来源:药智医械数据
2.2C反应蛋白检测试剂医疗器械产品注册形式
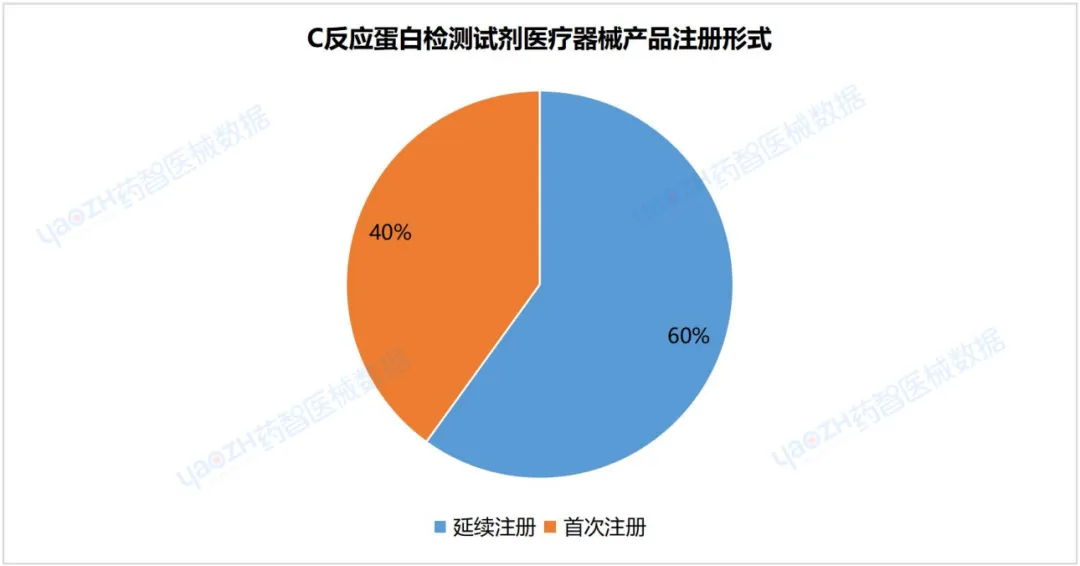
从产品注册形式来看,截至2024年3月,在有效期内C反应蛋白检测试剂医疗器械产品首次注册数量为352项,延续注册产品数量为527项。
数据来源:药智医械数据
2.3医疗器械产品品类注册数量排名情况(TOP10)
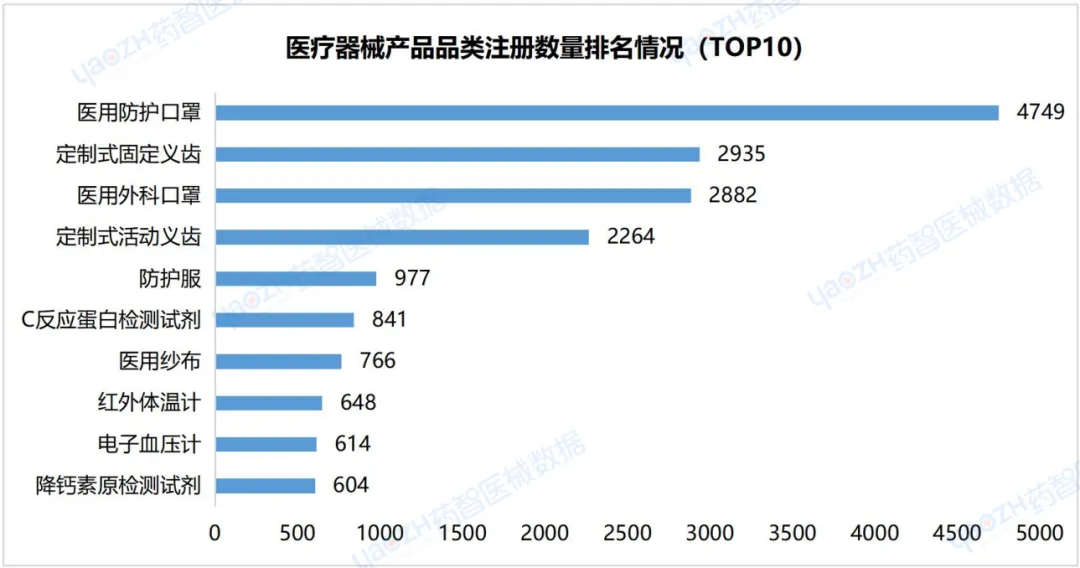
从医疗器械产品各品类注册数量来看,截至2024年3月,在有效期内的C反应蛋白检测试剂医疗器械注册数量排名第六。
数据来源:药智医械数据
2.4C反应蛋白检测试剂医疗器械产品国产&进口产品注册情况
据统计,截至2024年2月,C反应蛋白检测试剂医疗器械大多为国产注册产品,五年国产化率达到94%左右。
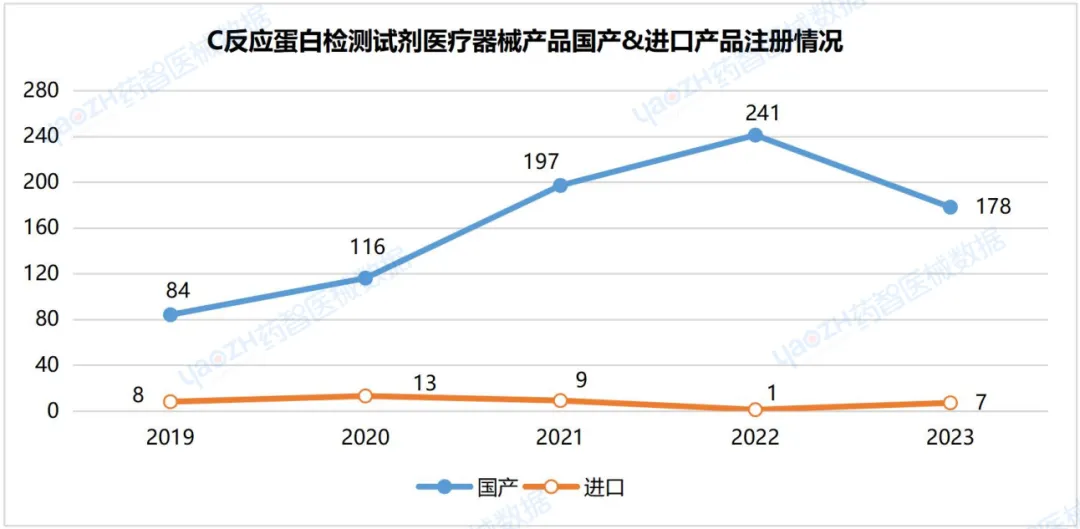
数据来源:药智医械数据
2.5国产C反应蛋白检测试剂医疗器械产品注册省份分布情况
截至2024年3月,共有24个省份(不包括中国港澳台)注册C反应蛋白检测试剂医疗器械产品,广东省国产产品注册数量排名并列第一,产品注册数为169件,占国产产品总数的20%。剩下排名前三的省份依次是:北京市104件,湖南省85件。
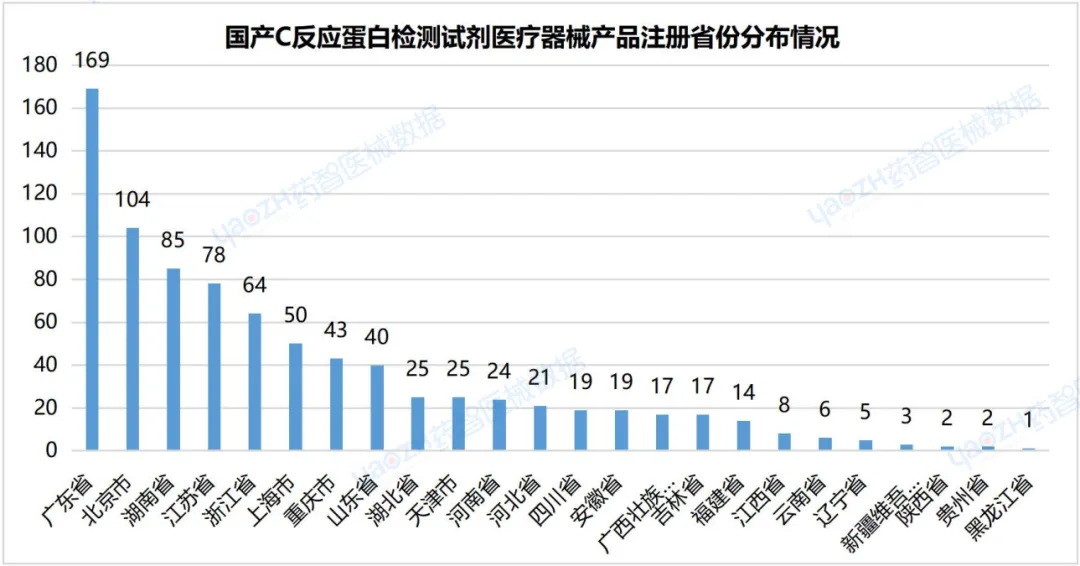
数据来源:药智医械数据
2.6国产C反应蛋白检测试剂医疗器械产品注册人情况(top5)
据统计,截至2024年3月,国内共有485家企业注册国产C反应蛋白检测试剂医疗器械产品,两家企业产品注册数量排名并列第一,分别为位于广东省的深圳市锦瑞生物科技股份有限公司和深圳市帝迈生物技术有限公司,产品注册数均为8件。
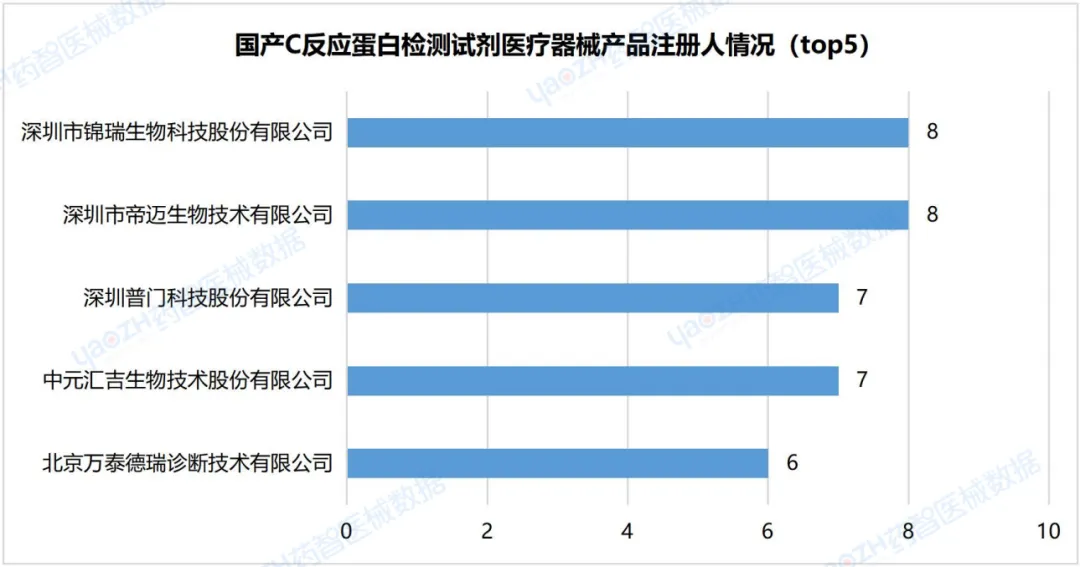
数据来源:药智医械数据
2.7进口C反应蛋白检测试剂医疗器械产品来源国家分布情况
据统计,截至2024年3月,进口注册C反应蛋白检测试剂医疗器械产品共38件,注册数量排名第一的国家是美国,产品注册数为12件。
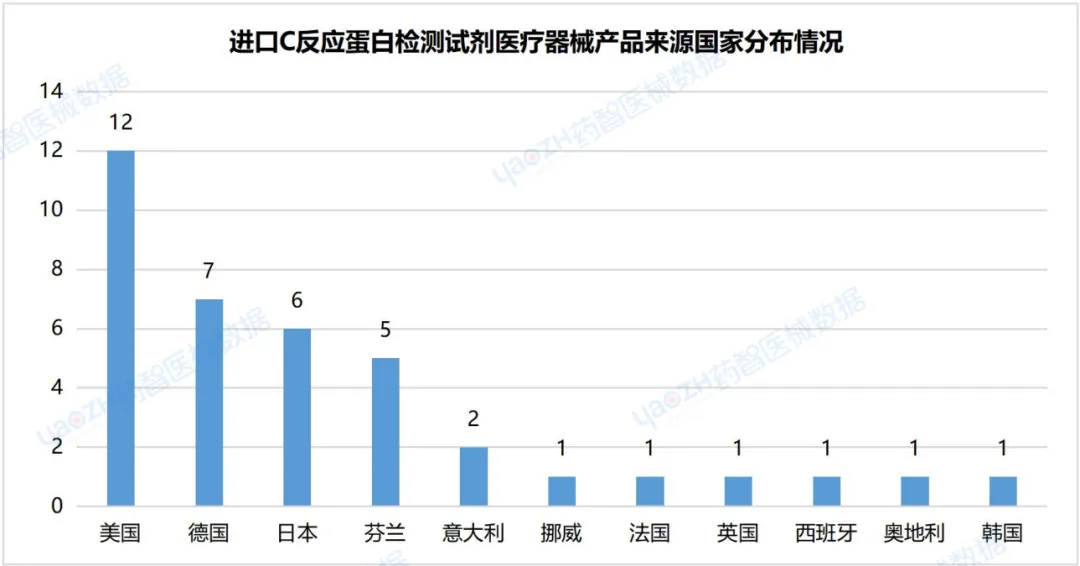
数据来源:药智医械数据
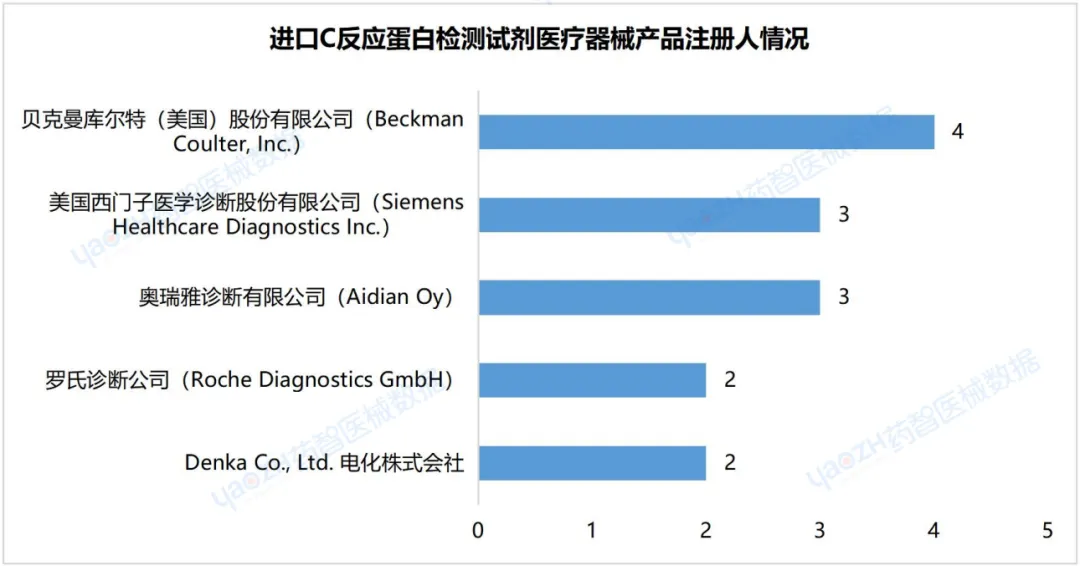
2.8进口C反应蛋白检测试剂医疗器械产品注册人情况
据统计,截至2024年3月,进口C反应蛋白检测试剂医疗器械产品注册数量排名第一的企业是美国的贝克曼库尔特(美国)股份有限公司(BeckmanCoulter,Inc.),产品注册数为4件。
数据来源:药智医械数据
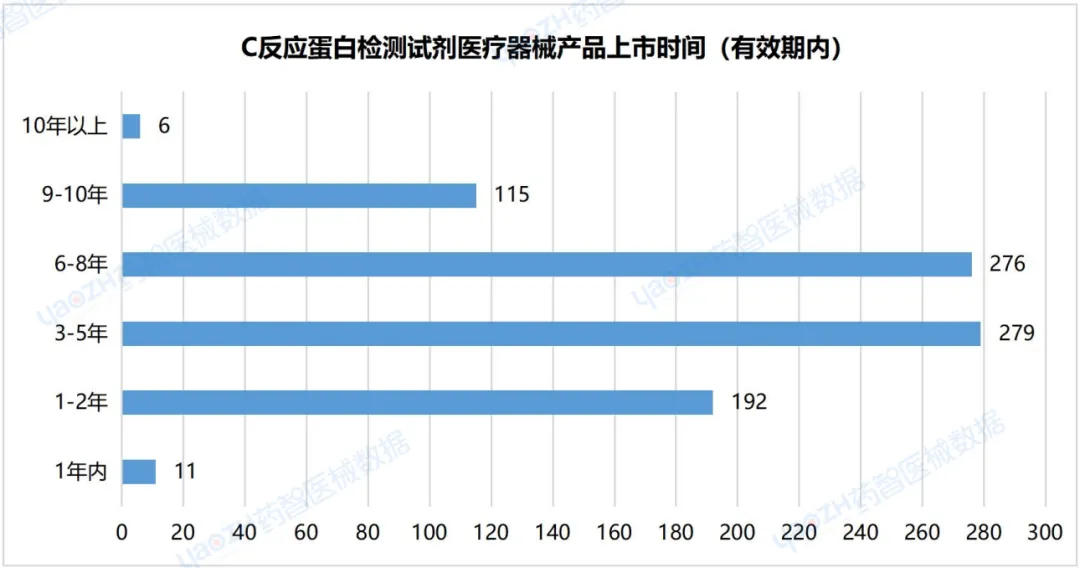
2.9C反应蛋白检测试剂医疗器械产品上市时间
据统计,从产品进入市场的平均时间来看,在有效期内的C反应蛋白检测试剂医疗器械产品的上市时间在3-5年的产品数量最多,有279件;其次为6-8年,有276件。
数据来源:药智医械数据
三、市场情况
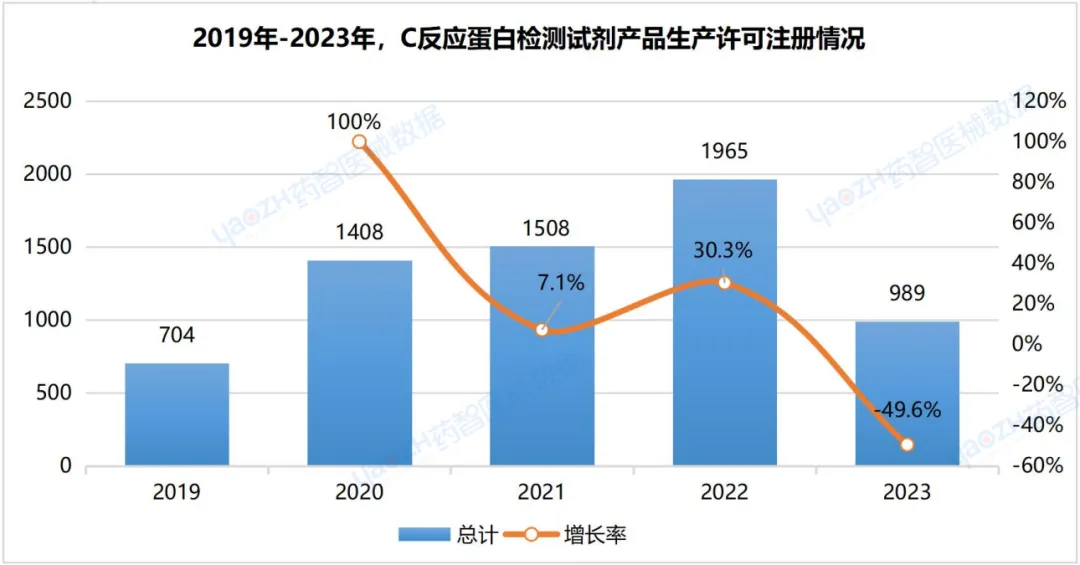
3.1生产企业
据统计,截至2023年8月,全国可生产C反应蛋白检测试剂医疗器械产品的生产企业共有4599家。2022年注册C反应蛋白检测试剂医疗器械产品生产许可证数量最多,为1965项。
数据来源:药智医械数据
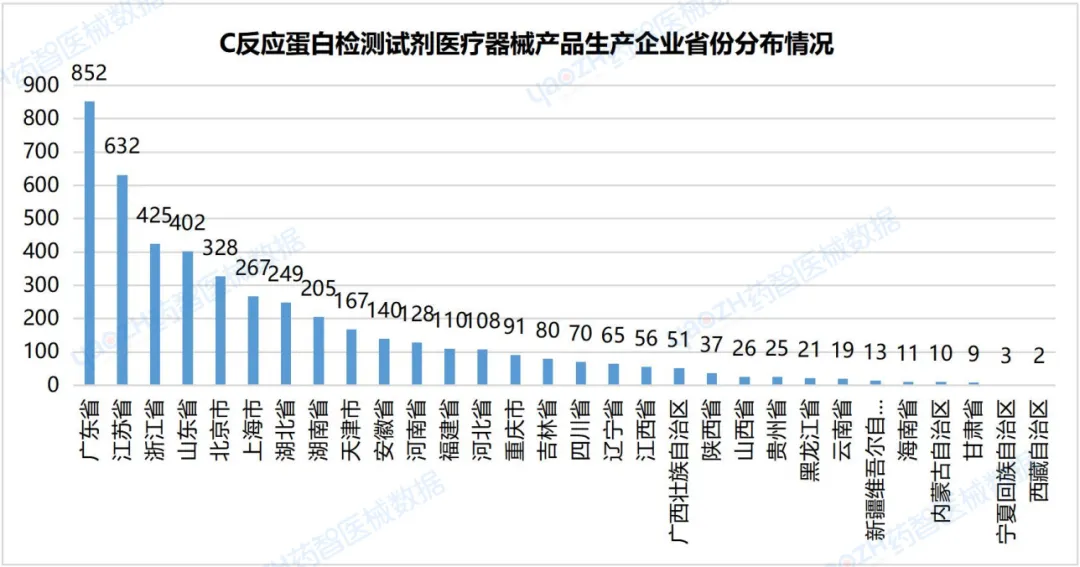
3.2C反应蛋白检测试剂医疗器械产品生产企业省份分布情况
据统计,从C反应蛋白检测试剂医疗器械产品生产企业省份分布情况来看,广东省可生产C反应蛋白检测试剂医疗器械产品的生产企业数量排名第一,为852家。剩余排名前三的省份依次是:江苏省632家,浙江省425家。
数据来源:药智医械数据
四、小结
本文基于总体趋势、企业分布、注册信息、市场情况等信息从多维度解析当前C反应蛋白检测试剂医疗器械产品发展趋势和行业现状,旨在客观评价C反应蛋白检测试剂医疗器械产品发展水平和发展质量,为相关企业立项评估、市场调研、投资决策等提供一定数据参考。相关数据均来源于药智网旗下的全球医疗器械大数据服务平台-药智医械数据。
据统计,2019年至2022年,我国C反应蛋白检测试剂医疗器械的注册数量呈现上升的趋势,2023年产品注册数量有所减少。截至2024年3月,已有879项产品完成注册,其中绝大多数为国产产品,国产化率高达94%。其中,有效期内首次注册C反应蛋白检测试剂医疗器械占40%。从产业规模来看,目前我国注册C反应蛋白检测试剂医疗器械产品数量最多的省份是广东省,占国产注册数量的20%。
在临床上,C反应蛋白检测应用领域广泛,能够用于鉴别细菌与病毒感染、指导用药、评估疗效、预测并发感染、观测感染持续时间、预测术后并发症以及提示疾病活动度等。与此同时,随着耐药菌株感染问题日益严重,病原体种类、细菌耐药性和易感性的变化也促使C反应蛋白检测的需求日益迫切。
近年来,在各类因素推动下,全球C反应蛋白检测试剂市场规模呈现出稳定的增长态势,并且预计未来几年将继续扩大。其中,中国市场作为全球市场的重要组成部分,其增长速度和规模将对全球市场产生深远影响。
总的来说,C反应蛋白检测在临床应用中具有重要的作用,随着全球及中国市场规模不断增长,其发展前景十分广阔。同时,也需持续关注病原体种类、细菌耐药性和易感性的变化,以优化和完善C反应蛋白检测技术和方法,为临床诊断和治疗提供更好的支持。

责任编辑:青霉素
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






