复星医药 Axi-cel作为二线治疗为不适合移植的R/R LBCL患者带来获益
大B细胞淋巴瘤(LBCL)是一种异质性的血液系统恶性肿瘤[1],大约有40%左右的LBCL患者在一线治疗后出现复发或耐药,进展为复发/难治性大B细胞淋巴瘤(R/RLBCL)[2]。近年来,靶向CD19的嵌合抗原受体T细胞(CAR-T)在复发难治B细胞非霍奇金淋巴瘤中取得了突破性进展[3]。
阿基仑赛注射液是复星凯特从美国KitePharma引进AxicabtageneCiloleucel(简称Axi-cel)技术,并获授权在中国进行本地化生产的自体靶向CD19CAR-T细胞治疗药品。2021年6月22日,国家药品监督管理局(NMPA)批准阿基仑赛注射液上市,用于治疗既往接受二线或以上系统性治疗后的复发或难治性大B细胞淋巴瘤(R/RLBCL)成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型(NOS)、原发纵隔大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL)和滤泡性淋巴瘤(FL)转化的DLBCL[4];2023年6月21日,阿基仑赛注射液二线新适应症上市申请获NMPA正式批准,其适应症为一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人LBCL[5]。阿基仑赛注射液二线新适应症在中国的上市,成功推动了中国成人LBCL的治疗新进展,为更多一线免疫化疗无效或复发的患者带来了新希望。
文献导读
HouotR,etal.AxicabtageneciloleucelinlargeBcelllymphomaineligibleforautologousstemcelltransplantation:thephase2ALYCANTEtrial.NatMed.2023Sep14.Onlineaheadofprint.
在临床实践中,大约有一半的复发难治性大B细胞淋巴瘤(R/RLBCL)患者不适合进行大剂量化疗与自体干细胞移植(HDCT/ASCT)且这些患者的预后通常较差。
研究达到了主要终点,Axi-cel输注后3个月时研究者评估的CMR为71.0%。研究者评估的最佳ORR与最佳CMR分别为90.3%与79.0%。
Axi-cel用于二线治疗不适合进行HDCT/ASCT的R/RLBCL患者,缓解率高、缓解持久且具有可接受的安全性。
研究背景
R/RLBCL患者的二线标准治疗方案(SOC)为挽救性免疫化疗后进行HDCT/ASCT。但在临床实践过程中,约有一半的R/RLBCL患者因高龄、合并症等因素不适合进行HDCT/ASCT,且这些患者在挽救性免疫化疗后的预后通常较差[6]。既往ZUMA-7研究已经证实,与SOC相比,Axi-cel在可移植的患者中具有更好的疗效,显著改善了患者的总生存期(OS):中位随访时间为47.2个月时,Axi-cel组未达到中位OS,而SOC组的中位OS为31.1个月,Axi-cel组的4年OS率高于SOC组(54.6%vs46.0%);与此同时,Axi-cel使患者死亡风险降低了27.4%[7]。
ALYCANTE是一项前瞻性、单臂、多中心、开放标签的临床Ⅱ期研究(NCT04531046),旨在评估Axi-cel在不适合进行HDCT/ASCT的R/RLBCL患者中的疗效和安全性[6]。
研究方法
2021年4月26日至2022年6月16日期间,共纳入62例来自法国18个中心的患者。符合条件的患者定义为一线免疫化疗后难治或12个月内复发的侵袭性B细胞非霍奇金淋巴瘤(B-NHL)成年患者,包括DLBCL、HGBL以及3bFL。根据医生的评估且符合以下任一标准的患者定义为不适合进行HDCT/ASCT:(1)年龄≥65岁;(2)年龄≥18岁且造血干细胞移植合并症指数(HCT-CI)评分≥3分;(3)既往接受过ASCT治疗(作为一线巩固治疗)。
患者接受清淋预处理方案为环磷酰胺500mg/㎡/d和氟达拉滨30mg/㎡/d,随后2-7天内进行Axi-cel静脉输注,目标剂量为2×106个CAR-T细胞/kg体重。
研究主要终点是研究者基于Lugano淋巴瘤疗效评价标准进行评估(以下简称为“研究者评估”)的Axi-cel输注后3个月时的完全代谢缓解(CMR)。研究关键次要终点包括研究者评估的Axi-cel输注后3个月时的客观缓解率(ORR)、研究者评估的Axi-cel输注后6个月时的CMR、以及研究者评估的最佳客观缓解率(bORR)与最佳CMR。CAR-T治疗相关不良反应包括细胞因子释放综合征(CRS)与免疫效应细胞相关神经毒性综合征(ICANS)等。
研究结果
数据截止至2023年1月19日,62例患者的中位年龄为70.0岁(范围:49.0-81.0岁),15例(24.2%)患者为女性,35例(56.5%)患者的国际预后指数(IPI)评分为≥3分,几乎所有患者的美国东部肿瘤协作组体能状态评分(ECOGPS)为0或1分(n=61,98.4%)。年龄≥65岁(n=55,88.7%)、HCT-CI评分≥3分(n=20,32.3%)和/或既往接受过ASCT治疗(n=2,3.2%)的患者均被认为不适合进行HDCT/ASCT。52例患者(83.9%)接受了桥接治疗,包括R-GemOx给药1个周期(n=25)、2个周期(n=25)或3个周期(n=1)和皮质类固醇(n=9)。在接受桥接治疗的患者中,63.4%对桥接治疗无应答(疾病稳定或疾病进展)(表1)。
表1患者基线特征
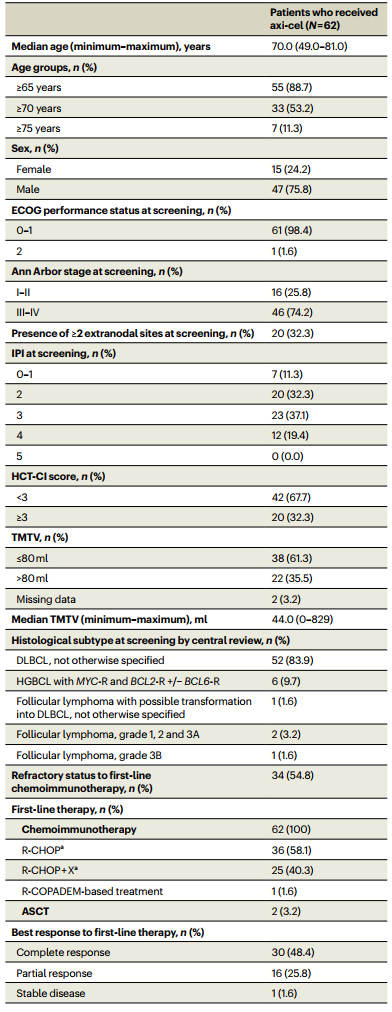

ECOGPS,美国东部肿瘤协作组体能状态评分;IPI,国际预后指数;HCT-CI,造血干细胞移植合并症指数;R-CHOP,利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP+X,在R-CHOP治疗方案基础上加用甲氨蝶呤(n=22)、依托泊苷(n=1)或其他研究性化疗药物(n=2);R-COPADEM,利妥昔单抗+环磷酰胺+长春新碱+泼尼松+多柔比星+甲氨蝶呤;ASCT,自体造血干细胞移植;R-GemOx,利妥昔单抗+吉西他滨+奥沙利铂。
研究达到了主要终点,Axi-cel输注后3个月时研究者评估的CMR为71.0%(95%CI,58.1%-81.8%),ORR为75.8%(95%CI,63.3%-85.8%);6个月时37例(59.7%)患者仍处于CMR状态(95%CI,46.5%-72.0%)。
研究者评估的最佳ORR与最佳CMR分别为90.3%与79.0%。中心审查小组评估的最佳ORR与最佳CMR分别为91.9%和82.3%(表2)。值得注意的是,在Axi-cel输注后1个月达到部分代谢缓解(PMR)的10例患者中,5例患者后续未接受任何额外治疗的情况下在3个月时转为CMR。
表2根据Lugano淋巴瘤疗效评价标准评估的代谢缓解

此外,中位随访时间为12.0个月时,Axi-cel组的中位无进展生存期(PFS)为11.8个月(95%CI,8.4%-未达到),12个月PFS率为48.8%(95%CI,34.0%-62.0%);中位OS未到达,12个月OS率为78.3%(95%CI,64.7%-87.1%);中位缓解持续时间(DOR)未达到(图1)。


图1Axi-cel输注后的PFS、OS与DOR的Kaplan-Meier分析
PFS,无进展生存期;OS,总生存期;DOR,缓解持续时间
Axi-cel同样表现出了可接受的安全性,3-4级CRS或ICANS的发生率分别为8.1%与14.5%。16例(25.8%)患者因CAR-T细胞相关毒副作用转入重症监护病房(ICU)。此外,33例患者发生了任何级别的感染事件,其中最常见的感染为新型冠状病毒感染(COVID-19,n=15)。数据截止时,共有12例患者死亡:5例死于淋巴瘤,1例死因不明,6例死于致命性感染事件(包括2例COVID-19,1例曲霉病,1例毛霉病,1例脓毒症以及1例会阴感染)。
表3CAR-T治疗相关不良反应

CRS,细胞因子释放综合征;Q,四分位数;ICANS,免疫效应细胞相关神经毒性综合征;CAR-T,嵌合抗原受体T细胞;ICU,重症监护病房。
研究结论
综上所述,ALYCANTE研究证实了Axi-cel作为不适合进行HDCT/ASCT的R/RLBCL患者的二线治疗,缓解率高且缓解持久。尽管这些不适合进行HDCT/ASCT的患者具有高龄、合并症等高危影响因素,但是Axi-cel仍具有良好的疗效与可接受的安全性。研究表明,Axi-cel作为二线治疗可为不适合进行HDCT/ASCT的患者带来获益。

责任编辑:木棉
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。

• 3大核心看点,构建CPHI China 2025合同定制展区创新生态圈,速来围观!
• 云顶新耀第三款商业化产品伊曲莫德在香港获批上市
• 美国上市!中国生物制药1类创新药派安普利单抗两大适应症获FDA批准
• “医工融合·创造未来”药械和生物制造投融资对接会成功举办
• 云顶新耀启动伊曲莫德本地化生产锚定20亿蓝海市场
• 荣灿生物LNP递送技术获美国专利授权,加速商业化及国际合作
• Sinclair欣可丽美学医美多功能操作平台V30注册申请获受理
• 突破性进展!华东医药ROR1 ADC创新药获FDA孤儿药认定
• 中国疾控中心:当前正值流感疫苗接种最佳时期
• Rutgers大学Keith Mickolajczyk教授课题组招募博士后
合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





