FDA肿瘤部门主任Pazdur:我们必须有一个公平的竞争环境
FDA很少有官员能像RichardPazdur一样拥有这么大的影响力。2023年,在他的领导下,肿瘤学卓越中心(OCE)批准了83种治疗药物,其中包括14种新药。
在近期首届AACR肿瘤行业合作活动上,Pazdur谈到了FDA肿瘤部门的一些关键议题,包括加速审批和验证性试验要求、咨询委员会会议、新的监管举措,甚至他的继任计划。
同时,Pazdur还对再生元申请加速批准其CD20/CD3双抗odronextamab治疗特定血液癌被拒的原因进行了解释。
一如既往,Pazdur的声明——有时直白幽默,有时战略模糊——为生物制药公司提供了对OCE的实践和优先事项的重要指导。
1、两封前所未有的CRL
3月25日,再生元宣布FDA拒绝加速批准odronextamab治疗复发性或转移性滤泡淋巴瘤(FL)和弥漫大B细胞淋巴瘤(DLBCL)。FDA发布了两份完全回复函(CRL),此举出人意料,这是第一次有药物因为验证性试验缺乏进展而被拒绝。
Pazdur表示,十多年来,FDA一直在谈论进行及时的验证性研究的重要性。2022年的《食品和药物综合改革法案》赋予了FDA一项权利,可以要求制药公司在加速批准的同时进行验证性试验,并在未满足上述条件的情况下拒绝批准药物。
AACR活动的一次炉边谈话中,Pazdur指出,对再生元的决定是为了在药物开发者之间建立一个公平的竞争环境。在odronextamab之前,FDA已经加速批准了三种CD20/CD3双抗,分别是罗氏治疗DLBCL的Columvi和治疗FL的Lunsumio,以及艾伯维与Genmab开发的治疗DLBCL的Epkinly。
在考虑是否发布CRL时,OCE采取了以患者为中心的方法。这意味着,在不同的情况下可能会有不同的裁决。
“如果真的没有其他的治疗选择,我们会提供一定程度的灵活性。然而,如果已有针对相同疾病的同类药物得到了加速批准,并且制药公司在加速批准时已经完成了大部分确证性研究,我们就必须为所有制药公司提供一个公平的竞争环境。”Pazdur解释说。
再生元提出的验证性研究已经开始,但仅在安全性引入(SafetyLead-In)阶段。由于该公司试图将odronextamab推到更早期的治疗环境中,因此,在实际的随机验证疗效部分开始之前,验证性试验被要求有额外的剂量探索研究。
FDA要求这些试验包括剂量确定和验证性两个部分,虽然已经开始了剂量确定部分的招募,但CRL表明,这些试验的验证性部分应该正在进行中。
Pazdur明确说,FDA希望申请方“进行这项研究”。这意味着实际的验证性研究需要“正在进行”,而不仅仅是在剂量探索寻阶段。但在其他情况下,包括作为OCE相对较新的“确认项目(ProjectConfirm)”的一部分,FDA“强烈建议”,在加速批准时,验证性试验“如果没有完全纳入,也应正在进行中”。
这表明FDA希望看到验证性试验进展的确切阶段。
“我们会具体问题具体分析。但这些研究必须被纳入进来,且我们必须对这些研究将满足预先设定的时间线有信心。”Pazdur表示,FDA希望制药公司尽早与他们讨论“全面开发计划”,包括验证性试验设计。
Pazdur补充道:“(入组)的确切数字需要讨论。我们必须有信心,加速批准不会影响试验的完成,也不会影响在同一疾病中可能出现的其他加速批准,特别是同一类药物。”
FDA过去曾遇到过这样的情况:新药获得批准后,患者不愿被随机分配接受以往的治疗方式,从而导致确证性试验无法纳入患者。
一些公司抱怨说,没有加速批准,他们可能没有资金进行大规模的随机试验,但Pazdur回应:资金不在FDA的考虑范围。
2、提高加速批准透明度
FDA加速审批途径的一个标志,是要求药物在验证性试验中证明其益处,但最近发表在JAMA上的一项研究显示,基于加速批准的许多癌症药物在5年后无法证明其生存效益。
研究人员审查了从2013年到2023年的129项加速审批。在这些药物中,有46种在2013年至2017年期间获得批准,到研究开始时已有超过5年的随访数据可供审查。而在这一组中,尽管在验证性试验中显示临床获益的不到一半(43%),但仍有63%的疗法转化为了完全批准。
针对这一问题,FDA也开始采取行动。
2021年以来,FDA加速批准的新药发生多起撤回事件,如PD-1加速批准适应症的陆续撤回,PI3K抑制剂凭借ORR数据上市后因安全性问题批量退市。2022年,FDA开始有意识收紧加速批准政策,尤其是将确证性临床的推进状态设置为加速批准的前提条件。
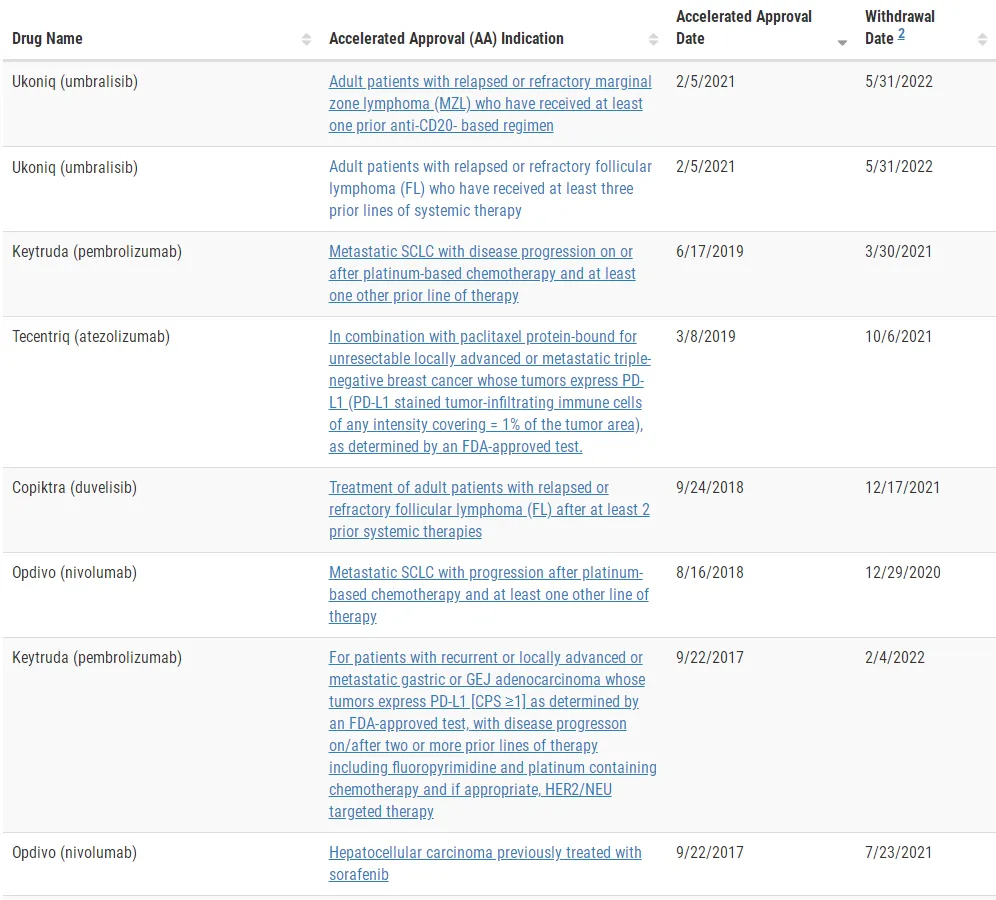
图源:医药笔记
虽然在加速批准的撤回上仍缺乏正式和快速的流程——比如,2009年到2022年间通过加速批准的药物中由于验证性试验表明缺乏获益,仅有23%的适应症被撤回;又比如,甚至有制药公司拒绝将被撤销的药物撤出市场——但从FDA近年的动作中,不难看到其正在加速改革。
作为OCE近年来推出的众多举措之一,ProjectConfirm旨在提高肿瘤加速批准的透明度。对于Pazdur来说,所有这些项目都是为了解决特定的问题。
举例来说,ProjectOptimus要求公司探索最佳剂量,而不是盲目地追求最高可耐受剂量;ProjectEquity旨在增加肿瘤学临床试验的多样性和包容性。
Pazdur希望看到更多进展的一个项目是ProjectPragmatic,该项目探索了在患者纳入标准和试验终点方面简化临床试验的方法。“我只是觉得,这么多年来,随着临床试验越来越复杂,我们好像把自己的生活置于了地狱中。如果试验变得更复杂,我无法想象,研究者如何向患者解释这一点。”
FDA此前与礼来、默沙东合作设计了一项由美国国家癌症研究所资助的III期试验,名为Pragmatica-Lung。这项研究评估了在接受免疫治疗和化疗的非小细胞肺癌患者中,Cyramza和Keytruda联合治疗与标准化疗的疗效。该试验只有一个简单的疗效终点——总生存期。但从那时起,该项目就没有引起任何生物制药公司的兴趣。
“我失望的是,虽然已经向工业界提出了许多建议,但他们没有接受。”Pazdur说,他已经与EMA以及日本的监管机构进行了讨论,并表示,制药公司不必担心这种简化的试验无法获得美国以外的批准。
Pragmatica-Lung只是实施Pazdur所强调的潜在“实效性试验(pragmatictrial)”的一种方式。这样一项简化的试验只收集了20%患者的安全性数据,和3级或以上的毒性,它还可以将人们何时开始新的治疗作为终点。
Pazdur说:“我要求大家和我们一起讨论这些统计设计。我们对实效性试验很感兴趣。”
与此同时,FDA也对进行验证性研究的时间延长表示担忧,并敦促制药公司缩短证明临床益处的时间,以尽量减少患者使用无效药物的可能。
但在某些情况下,有些药物开发商对于验证性试验拖拖拉拉,这些选择“以拖延换时间“的药物往往是那些价格昂贵,销售额可达数百万美元的产品,多在市场上待一天,就能获得不菲的“收入”。
3、咨询委员会与建立信任
当对一项申请有疑问时,FDA会召集外部专家团队,组成咨询委员会会议,讨论有关药物批准的关键问题。
FDA局长RobertCaliff认为,大多数咨询委员会会议不需要投票表决,但对Pazdur来说,投票对OCE至关重要,至少在涉及特定药物申请时是如此。“许多主张不设立投票问题的人并没有进入审查部门。我已经参加了25年的会议,在投票之前,我不知道这里会发生什么。但可以明确的是——我们必须做出决定。”
Pazdur将参加咨询委员会会议的公司描述为“fire-breathingdragon”。因为每个人对委员会专家的态度都有不同的看法,并且考虑到数百万或数十亿美元的研发费用和潜在的销售处于“危险之境”,有必要通过投票来解决这个问题。
Pazdur并不是唯一一个支持投票的人,FDA新药办公室主任PeterStein也表示认可,“投票很重要”,可以让专家解释自己的看法。
但Pazdur也表示,这些会议需要做出一些改变。
为了进行真正有吸引力的讨论,Pazdur希望会议能得到所有人的亲自出席。他还希望减少对澄清问题的强调,而将更多的时间放到最重要的“获益-风险”问题上。
Pazdur说:“我很少这么说,但我确实因为制药公司不得不接受一些毫无意义的审问感到抱歉。我甚至不知道专家们为什么提出一些与当前问题没有任何关系的疑问。”
Pazdur还担心,越来越多的试验研究者与委员会成员有个人或学术关系,可能会影响委员会对一款药物的态度。“如果这种情况继续下去,可能会导致人们对这个体系缺乏信心。”
咨询委员会之外,Pazdur认为,他和制药公司的互动,也是与公众和肿瘤审核人员建立信任的关键。“我不会接制药公司有关具体事务的电话,我觉得这会破坏FDA的进程。”Pazdur表示,自己甚至很少去参加与FDA小组的公司会议。
此前,在FDA批准AD药物Aduhelm之前,FDA前神经科学主管BillyDunn曾与渤健的前研发主管AlSandrock进行过一次具有争议的会面。一名FDA官员和一名制药商之间过于亲密的关系,引发了巨大讨论,并引起国会调查。
Pazdur认为,与一家公司的私下讨论也会导致FDA内部的不信任。“这是审查部门必须做的事,他们对一款药物的决定是在为其真正的效用负责。”
作为FDA中心的三位领导者之一,Pazdur与生物制品评估和研究中心主任PeterMarks、最近接替退休的JanetWoodcock副局长一职的NamandjéBumpus一起,成为FDA具有影响力的官员。
当被问及谁将接任OCE的指挥棒时,Pazdur表示,决定谁将接任不是他的职责。他强调,重要的是要同时考察该机构内部和外部的候选人,并指出他来自学术界。
“这不是我的责任,也不应该说这是RichardPazdur的哲学。”他补充道,“有时候改变一下是一个好主意。”
参考文献:
1、AACR:'Wehavetohavealevelplayingfield'—FDAoncologychiefexplainsconfirmatorytrialrejection
2、'Most'cancermedsapprovedunderFDA'sacceleratedpathwaycouldn'tprovesurvivalbenefitafter5years:study
3、覆水难收:当FDA撤回“加速批准”,会给国内药监怎样的启示;深蓝观

责任编辑:白芨
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。
—————————战况播报—————————
2024中国医药CRO/CDMO企业排行榜评选活动
投票进行时
截至4月12日11:00时,已有124家企业报名参赛。累计投票数达118225票,访问量达57万+;
都正生物凭借22121票暂列CRO企业人气品牌榜首,科默医药和南京威凯尔分别暂居第二、第三;
亚宝药业以11252票暂居CDMO企业人气品牌榜第一,华益药业和亨迪药业分别暂居第二、第三。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






