创新药风口:靶向蛋白降解技术强势崛起
靶向蛋白降解技术(TPD)是一种有广阔前景的治疗方法。与传统抑制剂相比,TPD在剂量、副作用和靶向“无成药性”蛋白质方面具有潜在的优势。除此之外,还可以克服现有小分子抑制剂(SMIs)的耐药性。TPD理论上可以结合目标蛋白的任何位点来引发降解,而传统小分子抑制剂必须在机制明确的结构域中起作用,这就为药物分子设计方面提供了便利。
TPD降解过程主要依靠两种细胞自毁机制——即泛素-蛋白酶系统和溶酶体降解途径。各种TPD策略(如蛋白水解靶向嵌合体、分子胶、溶酶体靶向嵌合体和自噬靶向嵌合体)已经被开发出来,这些方法对靶向功能失调蛋白具有很大的潜力,在将来可能成为新的治疗方法。
众所周知,功能失调蛋白的积累会导致各类疾病(如糖尿病、癌症、自身免疫性疾病、心血管疾病和神经系统疾病)的发生。例如,tau蛋白积累是阿尔茨海默病、额颞叶痴呆、皮克病和慢性创伤性脑病的病理标志,因此tau蛋白也被认为是治疗痴呆症的靶点。最近有报道称,一种名为C004019的蛋白水解靶向嵌合体(PROTAC)分子选择性地促进tau消除,这一发现提供了一种治疗阿尔茨海默病和相关tau病变的新方法。
自本世纪初以来,许多TDP策略被相继开发,包括PROTACs、溶酶体靶向嵌合体(LYTACs)、自噬靶向嵌合体(AUTACs)、自噬系固化合物(ATTECs)、分子胶降解剂、Trim-Away、tag靶向蛋白降解剂(tTPD)系统等。目前大约有20种TPDs正在临床试验中。TPD策略为开发新疗法提供了全新的可能性,并为药物开发提供了新思路。本文回顾了TPD技术的最新进展,并介绍了其发展成为新疗法的潜力以及局限性。
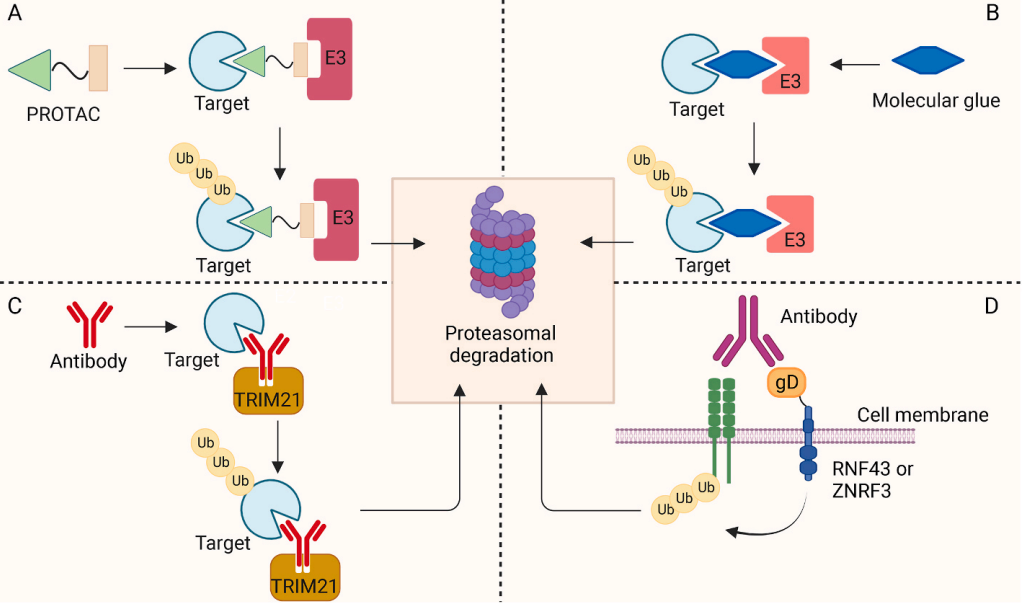
图1基于UPS的TPD原理图
1、基于泛素-蛋白酶体系统(UPS)的TDP策略
UPS是控制细胞中蛋白质含量的主要蛋白水解系统。它由泛素、三种关键酶、26S蛋白酶体和蛋白质底物组成。蛋白质先被泛素标记,然后被蛋白酶体识别和降解。例如,在三磷酸腺苷(ATP)水解反应中,泛素激活酶E1激活并将泛素传递给泛素结合酶E2。之后,E2酶在E3泛素连接酶的帮助下将泛素转移到底物,泛素连接酶E3识别并选择性地将泛素结合到特定位点上。随后,蛋白酶体以ATP依赖的方式催化泛素化底物的降解。
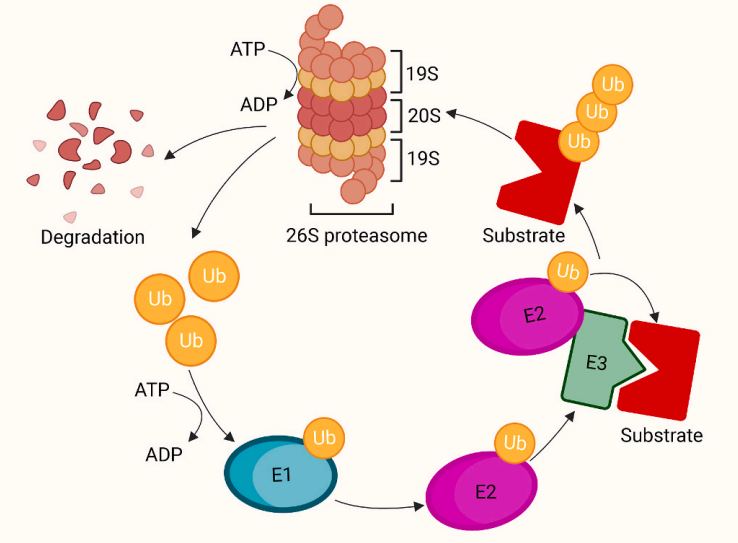
图2UPS作用原理
E3连接酶是UPS级联反应中的关键酶,它识别底物并将底物泛素化标记。值得注意的是,在人类基因组中存在600多种E3连接酶,其中一些E3连接酶可用于TPD策略靶向并消除多种细胞内和跨膜蛋白底物。接下将对这些方法进行全面的概述,并总结目前的进展和挑战。
1、PROTACs
PROTAC是一种双功能分子,它包含三部分:靶蛋白的配体、用于结合和募集E3泛素连接酶的另一配体以及连接两个配体的连接体(linker)。从机制上来说,PROTAC分子同时与E3连接酶和靶蛋白结合,形成三元复合物(E3连接酶-PROTAC-靶蛋白)。随后,靶蛋白被泛素标记,并通过蛋白酶体靶向降解。2001年,Sakamoto首先报道了第一代靶向蛋氨酸氨基肽酶-2的PROTACs。
然而,这些多肽类药物膜通透性低,化学稳定性差,限制了其临床应用。2008年,小分子的第二代PROTAC被开发出来,由是引起了社会关注。从那时起,各药企研发部门对这项技术投入了相当多的资金和精力,直至目前已有超过10余种PROTAC进入临床试验。
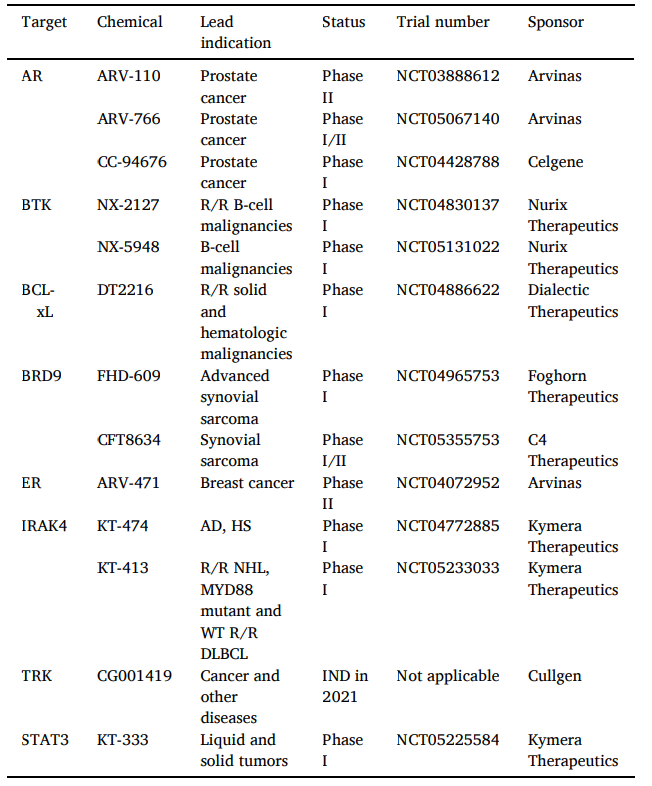
表1部分在临床开发中的PROTACs
与传统的SMIs相比,一种PROTAC分子可以降解多种等效的靶蛋白,从而增强药效学并降低毒性,这种药理机制使PROTACs具有先进的选择性和药效,并具有一定抗耐药性的能力。此外,PROTAC技术还消除了对结合受体或酶发挥作用的活性位点的需求,因而重新定义了不可成药的靶点。
然而,PROTACs的双功能性也导致其具有复杂多变的理化性质。这种不确定性影响了其吸收、分布、代谢和排泄(ADME)特征,从造成PROTACs的药代动力学研究困难。此外,尽管PROTACs可以有效地降解蛋白质,但当目标蛋白(POI)在正常组织中是必需成分时,研究人员应仔细考虑靶毒性的可能性。PROTACs的有效性也受到某些特性的限制,包括高分子量、高疏水性、E3依赖性和潜在的脱靶毒性。
2、分子胶
分子胶是一种诱导生物分子发生相互作用的新型小分子降解剂。与PROTACs类似,它们通过诱导靶蛋白和E3连接酶的蛋白-蛋白相互作用来实现其功能。“分子胶”一词在20世纪90年代初首次被用于描述免疫抑制药物环孢素A和FK506(他克莫司)所使用的蛋白-蛋白结合机制。
现已证明免疫调节亚胺药物沙利度胺及其衍生物可以作为分子胶。这些化合物通过招募E3泛素连接酶来降解疾病相关蛋白以发挥其治疗作用。Indisulam可以募集DDB1和CUL4相关因子15(DCAF15)E3连接酶并引发RNA结合基序蛋白39(RBM39)的降解。此外,小分子BI-3802作为分子胶,可以通过募集SIAHE3泛素蛋白连接酶1(SIAH1)诱导致癌转录因子B细胞淋巴瘤6(BCL6)的降解。近年来,分子胶降解剂已成为研究的热门话题,目前已有一些分子胶降解剂正在临床试验中进行评估。
这种类型的降解剂促进了新型疗法的发展,这些降解剂对各种严重疾病(如恶性肿瘤、感染、炎症和免疫疾病)的特征蛋白具有显著的降解活性,因此有潜力成为高效的治疗手段。尽管分子胶的作用方式与PROTACs类似,但它们仍具有明显的优势,即更低的分子量、更好的细胞渗透性和药物耐受性。
回顾经典分子胶的发展进程,它的发现具有一定偶然因素,且由于对其调控因素的认知有限、缺乏系统的发现策略,分子胶的合理设计仍面临挑战。因此,成功开发的药物还很少。分子胶这一领域的研究目前尚不成熟,在其合理应用于临床之前,还需要进行更深入的研究。
3、Protabs
近年来,研究人员报道了介导跨膜蛋白降解的PROTABs。将可识别糖蛋白D的N末端表位的抗体臂与已知的IGF1R的抗体进行组装而得,即PROTABs(Proteolysis-targetingantibodies)。研究人员将PROTABs加入到表达RNF43或ZNRF3融合的的细胞中,发现细胞表面的IGF1R蛋白被诱导降解,而不表达异位连接酶的细胞则不受影响。
为了证明PROTABs的普适性,研究人员设计了靶向另一种膜相关蛋白,即人表皮生长因子受体2(HER2)的Protab。HER2-Protab在细胞和小鼠模型中诱导HER2降解效果显著,并且在来源于患者的结直肠癌类器官中也可诱导肿瘤特异性降解。此外,研究人员还设计了靶向程序性死亡配体1(PD-L1)的Protab,结果也证明Protab策略可以靶向几种相关的膜蛋白。
尽管Protab的临床应用还有待进一步探索和改进,但这种方法提供了一种可以改善药物的细胞渗透性和生物利用度的新方法。此外,PROTABs表现出更好的组织选择性,具有良好的生物安全性。未来,PROTABs与抗体工程相结合发展,将成为药物开发的一个全新领域。
2、基于溶酶体降解途径的TPD策略
溶酶体是细胞中的降解中心,通过内吞、吞噬和自噬途径介导细胞外和细胞内物质的降解。内吞是细胞从外部环境中吸收物质的过程。吞噬与内吞密切相关,该过程首先以受体依赖的方式摄入直径>0.5μm的颗粒,然后将其消除。自噬是一个动态的自降解过程,它能将细胞质成分(如蛋白质、细胞器和病原体)在溶酶体内进行降解。现已有许多基于溶酶体途径降解失调蛋白的TPD策略被开发,如LYTACs、基于抗体的PROTACs(AbTACs)、ATTECs、AUTACs、靶向自噬的嵌合体(AUTOTACs)以及双特异性适配体嵌合体。
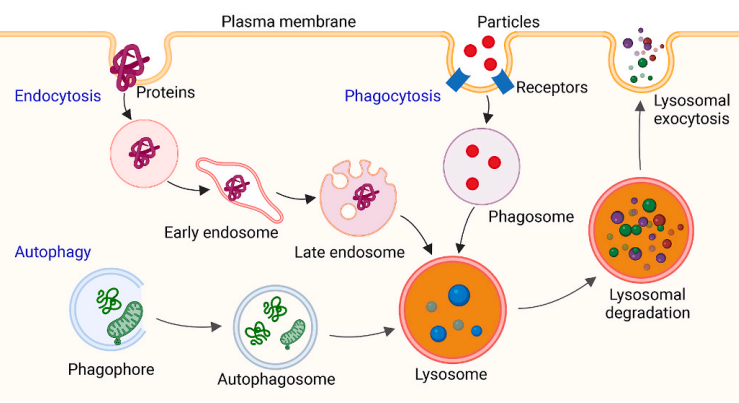
图3溶酶体降解的不同途径
基于溶酶体的TPD策略可以克服基于蛋白酶体的TPD策略的缺点,并提供靶向细胞膜内外受损细胞器和致病蛋白的成药可能。
1、LYTACs
LYTACs是一类双功能蛋白降解物,它主要通过将靶蛋白招募到细胞表面溶酶体穿梭受体来靶向细胞外蛋白和膜蛋白。这些降解物介导内体-溶酶体降解。Banik等人首次报道的第一个LYTAC由结合靶蛋白的单克隆抗体和用作阳离子非依赖性甘露糖-6-磷酸受体(CI-M6PR)配体的寡糖肽片段(polyM6Pn)组成。研究表明,基于抗体的LYTAC靶向多种膜结合蛋白和细胞外蛋白,如载脂蛋白E4、表皮生长因子受体(EGFR)、PD-L1和CD71,并诱导其溶酶体途径降解。
作为主要靶向细胞内蛋白的PROTACs的补充,LYTAC扩展了TPD策略的范围。然而,在它们的利用方面存在着某些挑战。例如,CI-M6PR对于LYTAC介导的靶标内化和降解是必不可少的,然而它并非组织特异性的,即可能会引起某些脱靶毒副作用。针对这一点,Ahn等人报道了一种新型LYTAC,即N-乙酰半乳糖胺-LYTAC(Galac-LYTAC)。这种类型通过利用Asialal糖蛋白受体(ASGPR),即一种肝脏特异性溶酶体靶向受体来实现特异性降解。此外,LYTAC还面临着大分子生物特征优化的挑战。幸运的是,这个问题可以通过基于适配体的LYTAC(Apt-LYTAC)来解决。最近,Wu等人开发了首个Apt-LYTAC。
它利用N-寡核苷酸适配子结合ASGPR的三链N-乙酰半乳糖胺配体,从而诱导靶蛋白的降解。Apt-LYTACs具有分子量低、化学稳定性高、合成简便高效等优点,可通过溶酶体降解途径有效介导膜蛋白酪氨酸激酶7(PTK7)和细胞外蛋白血小板衍生生长因子(PDGF)的降解。Miao等人报道了双特异性适配体嵌合体,它拥有与LYTAC类似的机制,通过内体-溶酶体途径介导蛋白质降解。
虽然LYTAC已被纳入TPD治疗策略,但在被作为治疗药物之前,还需要进一步探明其在人体中的行为特征,如ADMET性质。尽管如此,LYTAC技术仍是选择性消除细胞外和膜相关蛋白的不二之选。
2、AbTACs
2021年,Cotton等人首次报道了AbTAC,该AbTAC通过重组双特异性抗体将跨膜E3连接酶RNF43募集到细胞表面蛋白上,并诱导溶酶体降解。作为概念证明,研究人员选择PD-L1作为降解靶点,并使用与RNF43结合的Fab-噬菌体序列和作为PD-L1结合剂的Atezolizumab产生双特异性免疫球蛋白G,称为AC-1。结果表明,AC-1可诱导多种类型细胞的PD-L1溶酶体降解,包括MDA-MB-241、MDA-MB-231、T24和HCC827细胞。
PROTAC只能介导细胞内蛋白的降解,而AbTAC则绕过这一限制,开创了一种降解蛋白的新思路。然而,虽然设计思路来源于PROTAC,但AbTAC确切的机制仍有待证明。特别是目前尚不清楚RNF43是否在内吞作用前泛素化靶蛋白的细胞内区域。此外,AbTAC于人体内形成,可以降低免疫反应的可能性。在筛选AbTACs的最佳降解效率时,细胞特异性、内吞动力学、RNF43的再循环都应被考虑,并应确定有无其他膜受体。
3、GlueTACs
2021年,Zhang等人报道了GlueTAC的开发,这是一种基于共价纳米体的PROTAC策略。GlueTAC主要由三部分组成:共价纳米体(GlueBody)、穿膜肽和溶酶体分选序列(CPP-LSS)。GlueBody共价附着在细胞表面表达的表面抗原上,CPP-LSS诱导GlueTAC-POI复合物内化以及随后的POI溶酶体降解。为了验证这一概念,研究人员将他们的策略应用于抗PD-L1纳米体,该纳米体可以通过阻断PD-1/PD-L1相互作用来恢复T细胞的细胞毒性。结果表明,GlueTAC能有效诱导细胞内PD-L1的内化和溶酶体降解,抑制免疫缺陷小鼠的肿瘤生长。
GlueTAC技术代表了一种降解膜蛋白的替代策略,具有高亲和力和无脱靶效应的优点。然而在实际应用中,仍有一些问题需要解决:GlueTAC利用纳米体中的非天然氨基酸增强与膜抗原的共价结合,由于共价结合通常与潜在的毒性有关,因此GlueTAC的安全性仍然存在风险。此外,GlueTAC的血清半衰期和肾脏清除率也需要进一步考察。
3、基于自噬-溶酶体途径的TPD策略
除了广泛使用的内体-溶酶体途径外,利用自噬-溶酶体途径消除致病蛋白的新技术(例如AUTACs、ATTEC、AUTOTACs和基于CMA的降解物)也有报道。
1、AUTACs
AUTAC分子由细胞内靶蛋白的特异性结合剂和一个标签组(对氟苯基鸟嘌呤[FBnG]-HaloTag配体)组成,该标签组模拟S-鸟嘌呤基化,诱导靶蛋白的k63-多泛素化。泛素化靶蛋白被自噬受体识别后即选择性自噬降解。Takahashi等人于2019年报道了首个AUTACs,他们最初使用烟曲霉素设计的AUTAC1靶向蛋氨酸氨基肽酶2(MetAP2)可以显著降低HeLa细胞中内源性MetAP2水平。
接下来,他们进一步利用合成的FKBP配体(SLF)作为FKBP12的配体,制备AUTAC2降解fk506结合蛋白(FKBP12)。结果表明,AUTAC2处理可显著消除HeLa细胞中的FKBP12。此外还设计了AUTAC3,即使用JQ1作为配体靶向转录调节因子BRD4。然而,AUTAC3仅能使A549细胞中BRD4蛋白含量略微降低。
最后,他们开发了一种名为AUTAC4的线粒体靶向降解物,该降解物利用2-苯基吲哚衍生物靶向线粒体,并使用FBnG单元作为降解标签。AUTAC4可减少小线粒体和受损线粒体的数量,减轻羰基氰化间氯苯腙诱导的线粒体凋亡和线粒体膜电位的丧失,并维持羰基氰化间氯苯腙处理后细胞内ATP水平。
此外,AUTAC4还可以促进线粒体自噬,以挽救急性线粒体损伤细胞。考虑到线粒体功能障碍与许多与年龄相关的疾病有关,AUTAC4和其他未来基于自噬的线粒体降解物可能是治疗此类疾病(如糖尿病、癌症、神经退行性疾病和心血管疾病)的有希望的治疗选择。
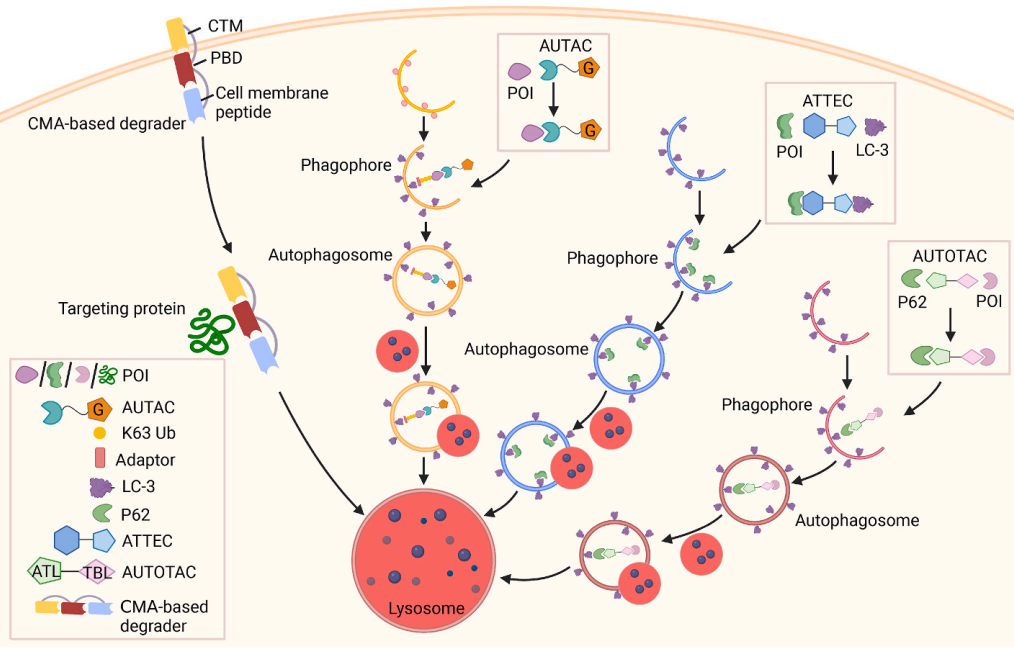
图4通过自噬-溶酶体途径降解技术的示意图
AUTAC是第一个使用自噬机制的TDP策略。AUTAC分子可以降解细胞质蛋白以及与疾病相关的线粒体碎片。这些发现可能为基于自噬的药物开发提供新的方向。AUTAC在其特定和更广泛的降解范围方面比基于UPS的降解系统具有独特的优势。然而,它通过复杂的多步骤机理起作用,其对全细胞蛋白质含量的安全性和有效性目前尚不清楚。因此,需要进一步的研究来确定AUTAC分子本身是否对选择性自噬过程产生影响,以及它们是否在体内起作用。
2、ATTECs
与基于自噬-溶酶体系统的AUTAC类似,ATTEC直接结合自噬受体微管相关蛋白1A/1B轻链3(LC3),触发致病蛋白的自噬降解。据Li等人报道,ATTEC是一组连接LC3和突变型亨氏蛋白(mHTT)的连接化合物。mHTT在细胞质中的聚集导致亨廷顿氏病(HD),它是一种无法治愈的神经退行性疾病。
因此,mHTT的降解代表了对抗HD进展甚至治疗这种神经退行性疾病的策略开发的希望。基于ATTEC平台,研究人员发现了四种化合物,它们成功地降低了细胞中的mHTT水平,并改善了HD小鼠模型中的疾病相关症状。该研究进一步表明,这些化合物还具有降解其他致病蛋白的能力,例如突变的Ataxin-3(ATXN3)。
通过直接结合自噬受体LC3并绕过泛素化过程,ATTEC可能具有通过直接机制降解不同类型底物(如胞质蛋白、受损细胞器、DNA/RNA分子)的潜力。为了最大激发ATTEC潜力,Fu等人开发了一种降解LDs的新策略,称为脂滴-ATTEC(LD-ATTEC)。自噬受体LC3和LDs可以通过LD-ATTEC连接,从而在细胞和小鼠模型中几乎完全清除LDs并减少LDs相关表型。LDs是细胞内细胞器,在能量储存和脂质释放中起关键作用。LDs的积累在多种疾病中都有表现,包括动脉粥样硬化、肥胖、炎症性疾病、Ⅱ型糖尿病、脂肪肝、心血管疾病和癌症。因此,LDs的特异性降解可能提供新的治疗策略。
ATTEC为非蛋白细胞组分的降解提供了一种新的途径。由于其优点(即低分子量,直接靶向降解机制,广泛的目标谱,即使在较低浓度下也有效),预计ATTEC将在未来得到进一步利用。
3、AUTOTACs
现有研究已经确定自噬受体p62在通过自噬清除错误折叠蛋白中起作用。p62同时具有泛素结合域和LC3相互作用区(LIR),这使其能够作为桥接分子同时识别蛋白载体上的泛素链和生长中的自噬体膜上的LC3,从而诱导自噬体的生物发生。Kwon等人通过p62依赖性自噬系统设计了AUTOTAC平台。AUTOTAC是一种双功能分子,由靶结合配体(TBLs)与自噬靶向配体(ATLs)使用重复聚乙二醇(PEG)片段结合并激活p62,使其成为自噬兼容的形式。AUTOTAC分子同时识别自噬受体p62和靶蛋白。ATL与p62的ZZ结构域结合,诱导p62自聚合,与自噬体蛋白LC3相互作用,以及自噬体的生物发生。
基于这一概念,研究人员设计了多种激活p62的小分子化合物,并在体外和体内测试了它们对可溶性蛋白的降解效果。PHTPP(雌激素受体β的非甾体合成配体)为基础的AUTOTAC(PHTPP-1304)设计靶向Erβ,它成功地诱导了几种类型癌细胞的p62自寡聚和ERβ降解。正如预期的那样,靶向MetAP2和雄激素受体的AUTOTAC有效地促进了p62的自聚合和靶蛋白的降解。此外,AUTOTACPBA-1105可以诱导P301L突变体tau自噬降解,形成神经原纤维缠结,从而导致突触功能障碍和神经元死亡。
AUTOTAC平台使多种细胞内蛋白质的选择性和有效降解成为可能。其关键在于可通过p62和LC3之间的直接结合来诱导降解,AUTOTACs不依赖于特定的连接物长度和靶蛋白的泛素化来降解。然而,在AUTOTAC平台应用于临床实践之前,需要进一步研究其组织选择性和脱靶效应。
4、基于伴侣介导的自噬(CMA)降解物
CMA是一种基于溶酶体降解途径的细胞内蛋白质选择性降解模式。机制上,分子伴侣Hsc70c识别底物蛋白中存在的KFERQ样基序,并将其引导到溶酶体相关膜蛋白2A(LAMP2A),这是一种受体,可将含有KFERQ基序五肽的胞质蛋白转运到溶酶体膜上。随后,底物蛋白通过多聚体LAMP2A复合物进入溶酶体进行降解。基于CMA的降解分子是由细胞膜肽、CMA靶向基序(CTM)和靶蛋白结合域(PBD)组成的双功能分子。
Fan等人报道了一种由CTM-PBD穿透肽TAT47-57组成的嵌合多肽,以可逆和剂量依赖性的方式有效地降低了多种蛋白质的水平,包括PSD-95、死亡相关蛋白激酶(DAPK1)和α-突触核蛋白(SNCA)。Zhou等人设计了一种膜渗透肽(DAT-CDK5-CTM),该肽阻断CDK5与N-甲基-D-天冬氨酸受体亚基2B(NR2B)的相互作用,导致小鼠缺血性卒中模型中CDK5降解。值得注意的是,CMA策略也能够靶向mHTT蛋白。
基于CMA的降解是一种以内源性蛋白质为目标的基于肽的新型降解策略。它为目前的TPD提供了一种补充方法,并促进了疾病治疗有效疗法的发展。然而,调节CMA的机制仍然知之甚少。由于CMA降解剂是肽类依赖性化合物,其稳定性和递送效率有待提高。因此,这一领域还需要进一步的研究。
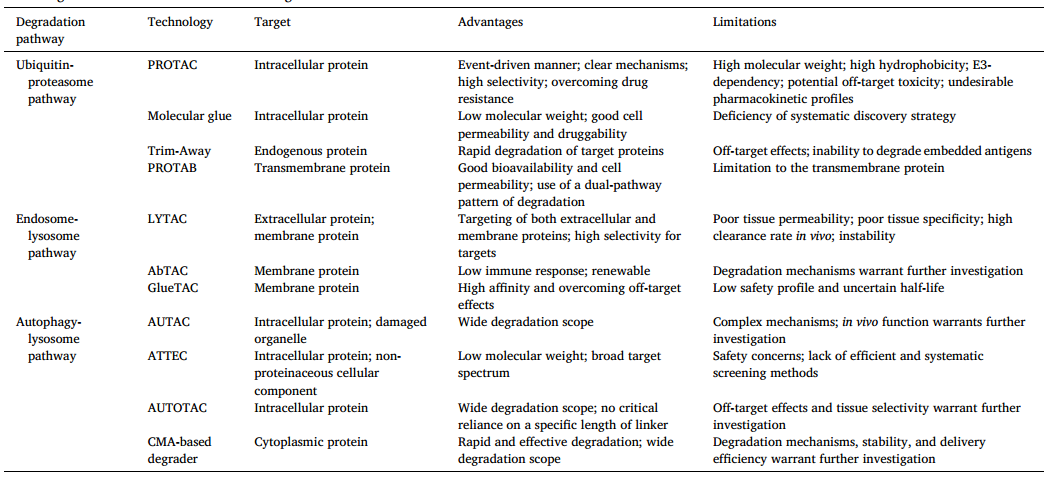
表2各种TPD策略的优点和局限性
4、tTPD系统
与在野生型基因组背景下工作的TPD降解剂(如PROTACs)不同,tTPD系统是一种新颖的创新技术,需要在POI上添加标记,例如氨基酸信号序列。这些化合物通过利用标记靶向降解剂促进标记POI的降解。tTPD系统通过劫持UPS诱导标记POI的快速、选择性和可逆降解。tTPD系统包括降解结构域(DD)、生长素诱导degron(AID)、HaloPROTACs、dTAG系统、IKAROS家族锌指3(IKZF3)肽degron、配体诱导亲和蛋白导弹(L-AdPROM)、BromoTag和靶向nanoluc的PROTACs(NanoTACs)。
对于许多学术实验室来说,为潜在目标开发定制类型的TPD是昂贵且不确定的。尽管如此,通过TPD技术和基因改造的结合,消除对特定配体的需求仍充满了吸引力。
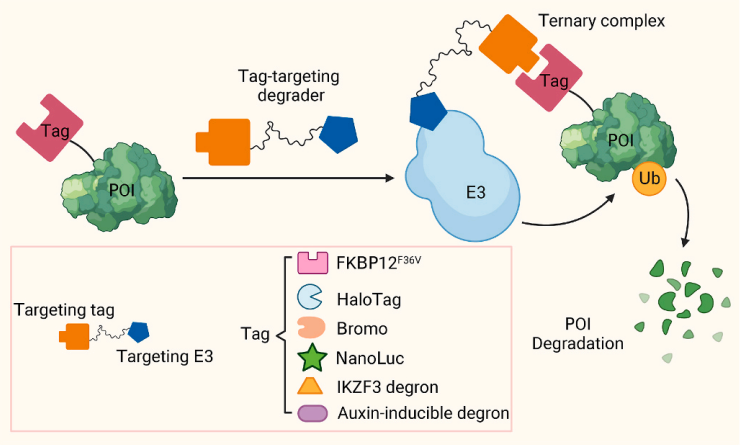
图5tTPD系统示意图
文章图片来源:同写意官微
随着tTPD技术的不断发展,其在药物开发领域具有很大潜力。它可能在确定前瞻性治疗靶点和靶点验证中发挥重要作用。
—小结—
众所周知,TPD可以有效降解致病靶蛋白,显示出巨大临床应用前景。在各种治疗TPD的方法中,PROTACs因其与经典抑制剂相比具有优越的选择性而受到广泛关注。
因此,多个PROTAC临床候选化合物已经从临床前开发推进到临床试验。然而,PROTACs仅通过UPS来消除细胞内蛋白,而溶酶体介导TPD策略(例如LYTACs和AbTACs)在降解细胞外和膜蛋白方面具有优势,因此这些溶酶体介导的TPD策略是TPD发展的一个重要里程碑。
然而,它们的适用性受到其高分子量、linker长度研究有限和药代动力学的挑战。此外,现有技术的优化和基于TPD的新技术(如Apt-LYTAC、ATTEC、AUTOTAC、CMA降解剂、GlueTACs等)的开发为新的蛋白降解模式的发展指明了方向。每种TPD技术都是为消除细胞内或细胞外的蛋白质而准备的。总之,这些技术组成了一个百宝箱,研究人员可以自行选择最合适的方法来降解目标蛋白。
目前,TPD以其优异的选择性和效率成为靶向降解的有力工具。TPD策略在癌症、慢性病、罕见病、病毒感染等疾病的治疗中显示出巨大的前景。此外,该技术还可以作为一种通用策略,用于确定TPD是否适合体外和体内给定目标蛋白的药物开发方法。尽管TPD技术具有诸多优势,我们仍需要开发新的蛋白质降解机制来克服现有TPD方法的局限性,如毒性、耐药性和有限的降解范围。
总的来说,TPD未来将是一种重要的治疗方法,它显示出充分临床实践价值。因此,可以合理地得出结论:TPD技术在药物开发方面具有很大的前景。
参考文献:
1、Targetedproteindegradationindrugdevelopment:Recentadvancesandfuturechallenges.EuropeanJournalofMedicinalChemistry261(2023)115839.
2、《靶向蛋白质降解:机制、策略和应用》.智慧牙新药科讯。
3、M.Goedert,D.S.Eisenberg,R.A.Crowther,Propagationoftauaggregatesandneurodegeneration,Annu.Rev.Neurosci.40(2017)189–210.
4、W.Wang,Q.Zhou,T.Jiang,S.Li,J.Ye,J.Zheng,X.Wang,Y.Liu,M.Deng,D.Ke,Q.Wang,Y.Wang,J.Z.Wang,Anovelsmall-moleculePROTACselectivelypromotestauclearancetoimprovecognitivefunctionsinAlzheimer-likemodels,Theranostics11(2021)5279–5295.
5、Y.Li,J.Song,P.Zhou,J.Zhou,S.Xie,TargetingundruggabletranscriptionfactorswithPROTACs:advancesandperspectives,J.Med.Chem.65(2022)10183–10194.

责任编辑:白芨
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






