百亿HER2单抗市场,曲妥珠单抗生物类似药是否能迎来春天?
曲妥珠单抗——HER2阳性乳腺癌患者的用药“金标准”
曲妥珠单抗(英文名为Trastuzumab,商品名为赫赛汀®),是由基因泰克(罗氏的子公司)研发的一种人源化IgG1κ型单克隆抗体,其与肿瘤细胞上的HER2结合并介导抗体依赖的细胞毒作用(ADCC)。于1998年9月25日获得美国食品药品管理局(FDA)批准,2000年8月28日获得欧洲药物管理局(EMA)批准,2001年4月22日获得日本医药品医疗器械综合机构(PMDA)批准,2002年9月5日获得中国食f品药品监督管理局(CFDA)批准上市,并由罗氏(美国的基因泰克,日本的中外制药)在美国、欧洲、日本和中国市场销售。
曲妥珠单抗作为抗HER2单克隆抗体靶向HER2,通过将自身附着在HER2上来阻止人体表皮生长因子在HER2上的附着,从而阻断癌细胞的生长,并可以刺激人体自身的免疫细胞去摧毁癌细胞,其作用机理包括:1)抗HER2单抗可以结合HER2的细胞外结构域,并且在与受体结合后,下调HER2的表达;2)与HER2结合后,抗HER2单抗下调了PI3K通路信号传导和细胞周期进展的下游介质,例如细胞周期蛋白D1;3)抗HER2单抗不仅抑制HER2信号传导途径,还引发针对HER2过表达细胞的免疫介导的应答。[1]

图1 赫赛汀®作用机制
数据来源:研报
根据药智数据检索得到曲妥珠单抗最新的中国说明书中公开的适应症为:1)HER2阳性的转移性乳腺癌:作为单一药物治疗已接受过1个或多个化疗方案的转移性乳腺癌;与紫杉醇或者多西他赛联合,用于未接受化疗的转移性乳腺癌。2)乳腺癌的辅助治疗:本品单药适用于接受了手术、含蒽环类抗生素辅助化疗和放疗(如果适用)后的HER2阳性乳腺癌的辅助治疗。3)HER2阳性的转移性胃癌:本品联合卡培他滨或5-氟尿嘧啶和顺铂适用于既往未接受过针对转移性疾病治疗的HER2阳性的转移性胃腺癌或胃食管交界腺癌患者。
目前,曲妥珠单抗已被国内外乳腺癌诊疗指南推荐用于HER2阳性乳腺癌患者各阶段的治疗,成为HER2阳性乳腺癌患者全程规范化治疗公认的“金标准”用药。
我国乳腺癌治疗药物市场“喜忧参半”
乳腺癌(Breast Cancer)是女性第一高发的恶性肿瘤,我国女性乳腺癌的发病高峰年龄为45-54岁,相比于欧美国家要提前10年左右。[2]据国家癌症中心2019年发布的数据显示,2015年我国女性乳腺癌新发病人数为30.4万例,发病率为45.29/10万,死亡率为10.50/10万。[3]特别是在每年新发乳腺癌病例中,约3%-10%的妇女在确诊时即有远处转移。即使是早期患者中,也有30%-40%可发展为晚期,5年生存率仅为20%。[4]我国晚期乳腺癌的诊疗形势十分严峻。
伴随乳腺癌分子生物学的研究的不断深入,根据雌激素受体(ER)、孕激素受体(PR)、HER2、Ki-67这四种指标,乳腺癌可以被分为5种分子亚型(具体原则如下表所示):luminal A型、luminal B型(HER2阴性)、三阴型、HER2阳性(HR阴性)、HER2阳性(HR阳性),其中HER2过表达型在所有乳腺癌中占比20%-25%,这种类型的乳腺癌通常具有较高的临床及病理分期和较差的预后。[5]
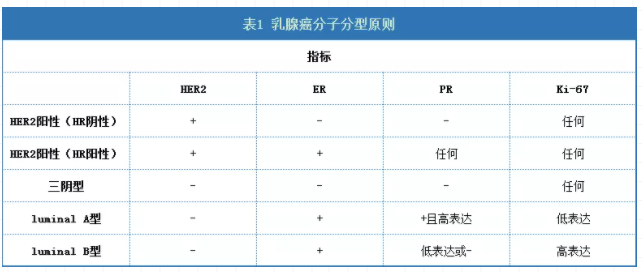
数据来源:CSCO乳腺癌诊疗指南2020
根据三生国健科创版上市招股说明书中引用的Frost & Sullivan报告,中国抗HER2单抗药物市场从2014年的约14亿元增长至2018年的约32亿元,期间年复合增长率为23.9%。随着乳腺癌新药的加速上市,预计该市场在2023年可达到约94亿元的市场规模,2018年至2023年的年复合增长率约为23.9%,并由2023年以约5.3%的年复合增长率继续增长至2030年的约136亿元。具体如下图所示。
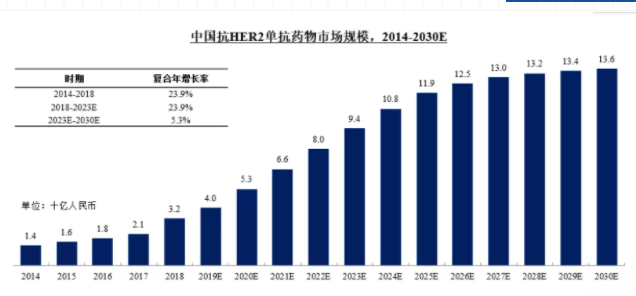
图2 2014-2030E中国抗HER2单抗药物市场规模
图片来源:三生国健科创版上市招股说明书
中国曲妥珠单抗生物类似药竞争格局
根据检索,目前国内仅有1个复宏汉霖研发的曲妥珠单抗生物类似药已经获批上市,值得注意的是,三生国健所研发的重组抗HER2人源化单克隆抗体伊尼妥单抗也已经于2020年获批上市,但根据三生国健所招股说明书中披露的内容,其不属于曲妥珠单抗的生物类似药,因此,下表为复宏汉霖所研发的曲妥珠单抗的生物类似药的具体信息。

数据来源:公开信息
另外,国内共有7个曲妥珠单抗的生物类似药处于III期临床进行中的阶段,其余生物类似药的进展如下表所示。
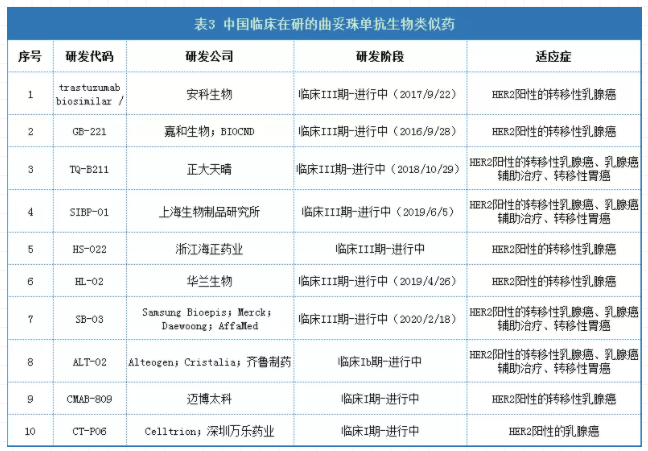
数据来源:药物临床试验登记与信息公示平台、药智数据
市场准入政策利好,生物类似药将迎来春天
曲妥珠单抗于2017年谈判进入国家医保乙类目录,每单位价格从24500元下降至7600元,降幅达到69%,并于2018年11月获准被纳入国家基本药物目录。2019年曲妥珠单抗谈判进入国家医保乙类目录,每单位价格从7600元下降至5500元,同时限制以下情况方可支付:1)HER2阳性的转移性乳腺癌;2)HER2阳性的早期乳腺癌患者的辅助和新辅助治疗,支付不超过12个月;3)HER2阳性的转移性胃癌患者。
截至2021年1月27日,中国已获批并销售的曲妥珠单抗仅有原研药赫赛汀®以及2020年由复宏汉霖研发的中国首个上市的曲妥珠单抗生物类似药,最新的中标价格如下表所示。
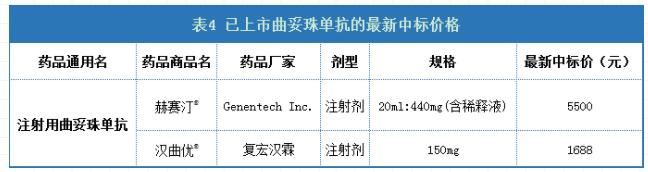
数据来源:药智数据
另外,根据国家医疗保障局于2020年7月15-16日召开的关于生物制品(含胰岛素)和中成药集中采购工作听取专家意见和建议的座谈会可知,目前部分单抗类品种已经具备“1原研+2仿制”的集采条件,可能会率先选择这部分品种进行生物药的集中采购试点。值得注意的是,曲妥珠单抗目前仅有原研药和复宏汉霖的生物类似药获批在中国上市,预计两年内竞争格局不会改变,因此进入集中采购可能还需要一段时间,并且随着大多数的单抗药物通过谈判进入医保目录,以及生物类似药的上市,价格大幅下降,基于单抗药物相对于化学药有较高的生产成本的情况下,即使进入集中采购,大幅降价的可能性也不大。
根据CDE于2020年7月20日发布的《注射用曲妥珠单抗生物类似药临床试验指导原则》的通知,对于国外已上市的曲妥珠单抗生物类似药,如申请在国内上市,可开展一项桥接性的临床有效性比对研究。因此,若曲妥珠单抗生物类似药已经在国外获批上市,在中国开展临床试验可能相比同类在国外未上市的生物类似药的进展速度略快。
综上所述,曲妥珠单抗生物类似药的竞争格局较为拥挤,竞争较为激烈,但是曲妥珠单抗在国内乳腺癌的治疗地位比较稳固,国内整体市场空间巨大,此外,目前胃癌HER2检测还需要继续推广,曲妥珠单抗在胃癌的治疗中还存在很大的市场渗透空间。曲妥珠单抗进入医保后放量明显,生物类似药上市后也不需要过多进行学术推广,可谓机遇与挑战并存。
参考资料:
1. 三生国健药业(上海)股份有限公司招股说明书
2. 中国抗癌协会乳腺癌诊治指南与规范(2019年版)
3. Overview of resistance to systemic therapy in patients with breast cancer
4. 沙利文:创新药行业市场研究报告(上)

责任编辑:三七
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。




研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



