【干货】化学仿制原料药DMF编写及实例分析
A
+
A
-
导读:姜博士在药智学院第四十八期课上,就化学仿制原料药DMF如何编写,结合具体实例进行了详细讲解,以下为PPT原文,分享给大家~~
作者简介
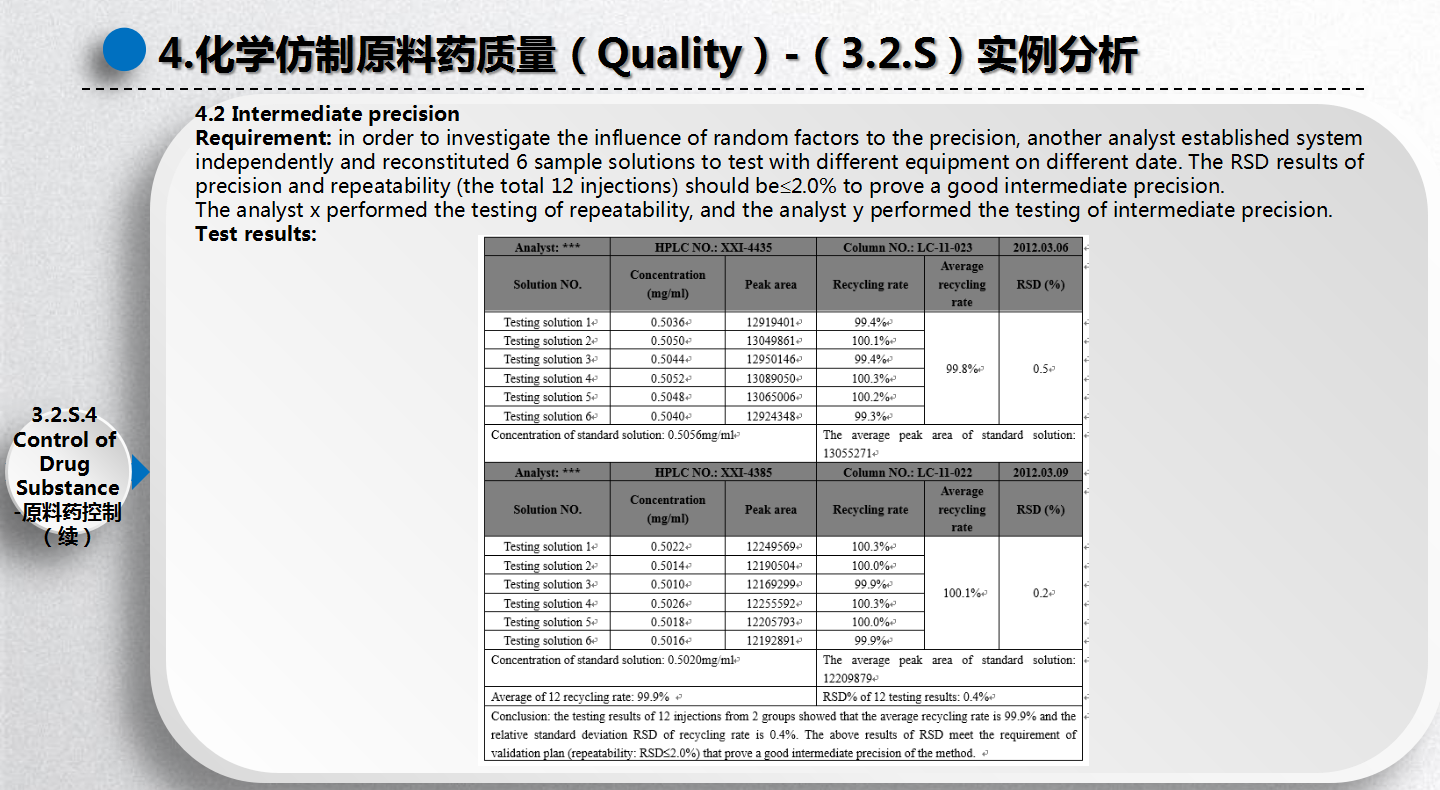
姜桥南开大学物理化学博士、浙江大学药物化学博士后,目前在丽珠集团原料药事业部任合成研发总监。之前任职于浙江华海股份有限公司、博瑞生物医药(苏州)股份有限公司和北大医药股份有限公司。有8年化学原料药产品研发与项目管理经验,熟悉原料药情报调研、专利分析、路线开发、工艺优化、中试验证与生产实施、污水治理技术、注册文件编写。到目前为止,已经指导完成小试项目22项,中试及生产项目10项;公布专利17项(其中1项提交PCT并进入美国),已授权5项;参与编写CTD3项,其中1项提交DMF。
CTD文件(Common Technical Document)是国际公认的文件编写格式,中国国家食品药品监督管理总局(CFDA)于2017.06.19成为ICH正式成员。CTD格式的应用是中国药品申报与世界接轨的桥梁,与FDA/EMEA申报体系的基本统一。根据美国的联邦管理法规定,药品进入美国须向美国FDA申请注册并递交有关文件,化学原料药按要求需提交一份药物管理档案(DMF)。
姜博士在药智学院第四十八期课上,就化学仿制原料药DMF如何编写,结合具体实例进行了详细讲解,以下为PPT原文,分享给大家~~
另外,想要获取121页“DMF文件样本”的朋友,可以添加药小智(17318481750)为好友,让小智单独发给您~~


































































































相关标签:
化学仿制原料药DMF
0
0
投稿
马老师
18323856316 (同微信)
商务
合作
合作
马老师
18323856316 (同微信)
公众号  扫码关注-药智网公众号
扫码关注-药智网公众号
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





