4款CGT疗法有望2024上岸
2023年,细胞和基因疗法(CGT)获批数量空前激增,美国FDA共批准了7款疗法。而2024年有望超过2023年,成为CGT疗法更具里程碑意义的一年。
截至4月29日,FDA已经为4款新的CGT疗法开了绿灯,分别为Iovance公司的Amtagvi、BMS公司的Breyanzi、OrchardTherapeutics公司的Lenmeldy以及辉瑞刚刚获批的Beqvez。
根据各公司披露的PDUFA日期,2024年FDA还将对另外4款CGT疗法作出审批决定。
表:2024年有望获批的4款CGT疗法
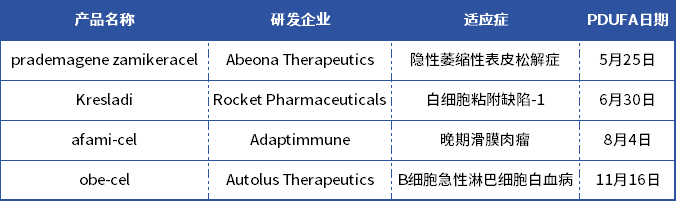
数据来源:BioSpace网站
1.prademagenezamikeracel(pz-cel)
研发企业:AbeonaTherapeutics
适应症:隐性萎缩性表皮松解症
疗法类型:基因校正细胞疗法
PDUFA日期:5月25日
AbeonaTherapeutics公司开发的pz-cel疗法利用逆转录病毒载体将产生胶原蛋白的功能性COL7A1基因导入患者自身的皮肤细胞,用于治疗隐性萎缩性表皮松解症(RDEB)患者。RDEB是一种罕见的结缔组织疾病,由于缺乏COL7A1基因,无法产生功能性VII型胶原蛋白,导致免疫力下降,从而引起严重的皮肤伤口、疼痛和危及生命的并发症。
2023年11月,基于VIITALIII期研究的临床数据和I/IIa期研究的长期结果,FDA授予pz-cel优先审查权。
如果pz-cel顺利获批,它成为继Krystal生物技术公司的Vyjuvek之后的第二款用于治疗DEB的基因疗法。Abeona公司3月份表示,正在为pz-cel在美国上市做积极准备,包括与治疗机构和支付方进行商讨。
2.Kresladi
研发企业:RocketPharmaceuticals
适应症:白细胞粘附缺陷-1
疗法类型:体外载体基因疗法
PDUFA日期:6月30日
RocketPharmaceuticals公司最初预计FDA将在3月份对Kresladi做出审批决定,但FDA要求更多的审查时间,最后将PDUFA日期延长至6月30日。
严重的LAD-I是一种影响儿童的罕见遗传性疾病,由ITGB2基因突变引起,会导致危及生命的感染。如果不定期进行骨髓移植,儿童期后的存活率极低。Kresladi含有经慢病毒载体基因修饰的患者造血干细胞,携带ITGB2基因的功能拷贝,该基因对白细胞粘附和抗感染至关重要。
2023年11月,FDA接受了关于Kresladi的BLA申请,并给予优先审查。与治疗前的水平相比,感染率明显降低,LAD-I相关皮肤病变也得到了缓解,伤口愈合能力也得到了恢复。
Kresladi还获得了FDA的再生医学高级疗法、罕见儿科疾病、快速通道和孤儿药认证。
Kresladi如若顺利获批,对患者而言是一个显著的进步,它提供了一种替代骨髓移植方案。骨髓移植具有重大风险,而且获得匹配的移植体难度较大。
Rocket正在加强其商业基础设施,为产品上市做准备,包括中心启动、渠道战略、教育和支付方参与。
3.afami-cel
研发企业:Adaptimmune
适应症:晚期滑膜肉瘤
疗法类型:T细胞受体疗法
PDUFA日期:8月4日
Adaptimmune正在为afami-cel的上市做准备,该产品用于治疗晚期滑膜肉瘤,PDUFA日期定在8月4日。Afami-cel已于2024年1月获得了FDA的优先审查。
Afami-cel是一种针对MAGE-A4阳性肿瘤细胞的单剂量工程化T细胞受体疗法。该疗法在SPEARHEAD-1试验中的临床数据显示,约39%的患者出现了临床应答,中位应答持续时间约为12个月。中位总生存期约为17个月,而接受过两种或两种以上疗法的患者的中位总生存期不到12个月。约70%的afami-cel应答者在治疗两年后仍然存活。
对比,FDA授予afami-cel孤儿药和再生医学高级疗法称号,用于治疗软组织肉瘤。
如果afami-cel获得批准,它将成为首个获批的治疗此类癌症的工程化T细胞疗法。
4.obe-cel
研发企业:AutolusTherapeutics
适应症:B细胞急性淋巴细胞白血病
疗法类型:CAR-T细胞疗法
行动日期:11月16日
FDA于2024年1月接受了AutolusTherapeutics为其新一代CAR-T疗法obe-cel治疗复发/难治性成人急性淋巴细胞白血病(ALL)而提交的BLA,并将PDUFA日期定为11月16日。
Obe-cel是一种研究性CD19CAR-T细胞疗法,与现有疗法相比,Obe-cel具有快速靶点结合率,最大限度地减少了T细胞活化,从而提高了临床活性和安全性。
2022年12月,Autolus公司宣布FELIXII期试验取得成功,中期分析显示obe-cel治疗白血病患者的总体缓解率达到70%。CAR-T细胞浓度达到峰值,在输注后166.5天后,外周血中CAR-T细胞浓度持续保持在75%。试验还显示出了良好的安全性。
Obe-cel获得了FDA授予的“孤儿药”和“再生医学高级疗法”认证。4月初,obe-cel上市申请获得欧洲药品管理局受理。
2月8日,BioNTech以2.5亿美元的价格获得了obe-cel的权益。Autolus预计,obe-cel的销售峰值将超过3亿美元。
Autolus可能面临来自吉利德科学子公司Kite的竞争,后者CAR-T疗法Tecartus在2021年获得了FDA批准。Tecartus是首个针对ALL的CAR-T疗法,实现了65%的完全缓解率。
资料来源:
1.https://www.biospace.com/article/5-cell-and-gene-therapy-decisions-to-watch-in-2024/

责任编辑:豌豆射手
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






