2021盘点:FDA批准27款first-in-class药物,83款ANDA首仿药,复星医药…
本报告重点资讯
2021年共计有83个ANDA在美国获得首仿药批准,部分国内已上市
2021年FDA批准的新药中共计有27款first-in-class药物
2021年复星医药旗下GLAND PHARMA LTD成为中国药企在FDA上市榜首
米诺地尔和普瑞巴林为企业在药智FDA上市热门检索药物
注射剂和片剂为企业在药智FDA上市热门检索剂型
2021年FDA批准药品概述
2021年是极为重要的一年,FDA下属药品审评和研究中心(以下称CDER)在2021年批准了许多不同的药物疗法,用以帮助患者减轻疾病,保护患者免受危及生命的疾病侵害。
结合药智美国上市药品数据库,2021年FDA批准药物疾病领域集中体现在心脏、血液、肾脏、内分泌疾病、自身免疫、炎症、肺部疾病、传染性疾病、神经和精神疾病、癌症。
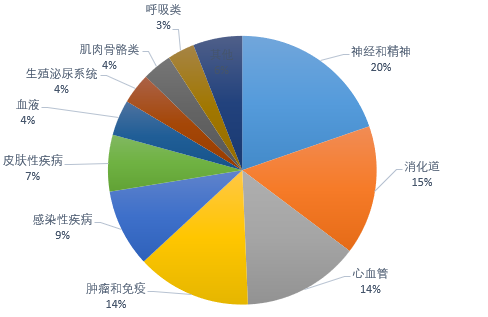
图一 2021年度FDA批准药物的疾病领域分布
(来源:药智数据美国上市药品数据库)
创新药批准
2021年,CDER批准了NDA 99个,BLA20个,其中新分子实体药(NME)即创新药共计50个。CDER批准的这些新药因其潜在的积极影响和对患者的独特贡献而备受业界关注。

图二 近10年CDER批准上市的创新药(来源:药智数据美国上市药品数据库)
First-in-class
根据药智美国上市药品数据库统计,2021年CDER批准了27款first-in-class首创新药(54%),以下介绍获批首创新药中值得注意的批准案例。
NO.1 ADUHELM (阿度努单抗注射剂)
由BIOGEN INC研发的ADUHELM于2021年6月7日获得FDA批准上市。ADUHELM是一种生物药,主要用于治疗阿尔茨海默病,该药是全球首个针对基本疾病病理生理学的阿尔茨海默病疗法。阿尔茨海默病是老年期痴呆最常见的一种类型,以进行性发展的神经系统变性为特征,是导致老年人失能的重要原因。ADUHELM的上市对阿尔茨海默病的治疗起到了积极作用。
NO.2 Brexafemme(艾瑞芬净片)
20多年来第一个获批的新抗真菌类药物Brexafemme,这是由SCYNEXIS研发的一种用于治疗的外阴阴道念珠菌病,酵母菌感染的药物。SCYNEXIS是一家总部位于美国新泽西州的生物技术公司,专注于开发创新疗法,用于难治性和常常危及生命的感染性疾病的治疗。SCYNEXIS提交的Brexafemme新药申请于2021年6月1日获得批准,并且在审评阶段就获得了FDA优先审评和快速审批通道的认定。
NO.3 Rybrevant(埃万妥单抗注射剂)
Rybrevant于2021年5月21日获批,主要用于治疗患有某些形式肿瘤具有特定突变的非小细胞肺癌成人患者。值得注意的是:Rybrevant是第一个获得FDA批准的针对非小细胞肺癌亚群的治疗药,并通过快速审批途径获得批准。
表一 2021年FDA批准的first-in-class新药
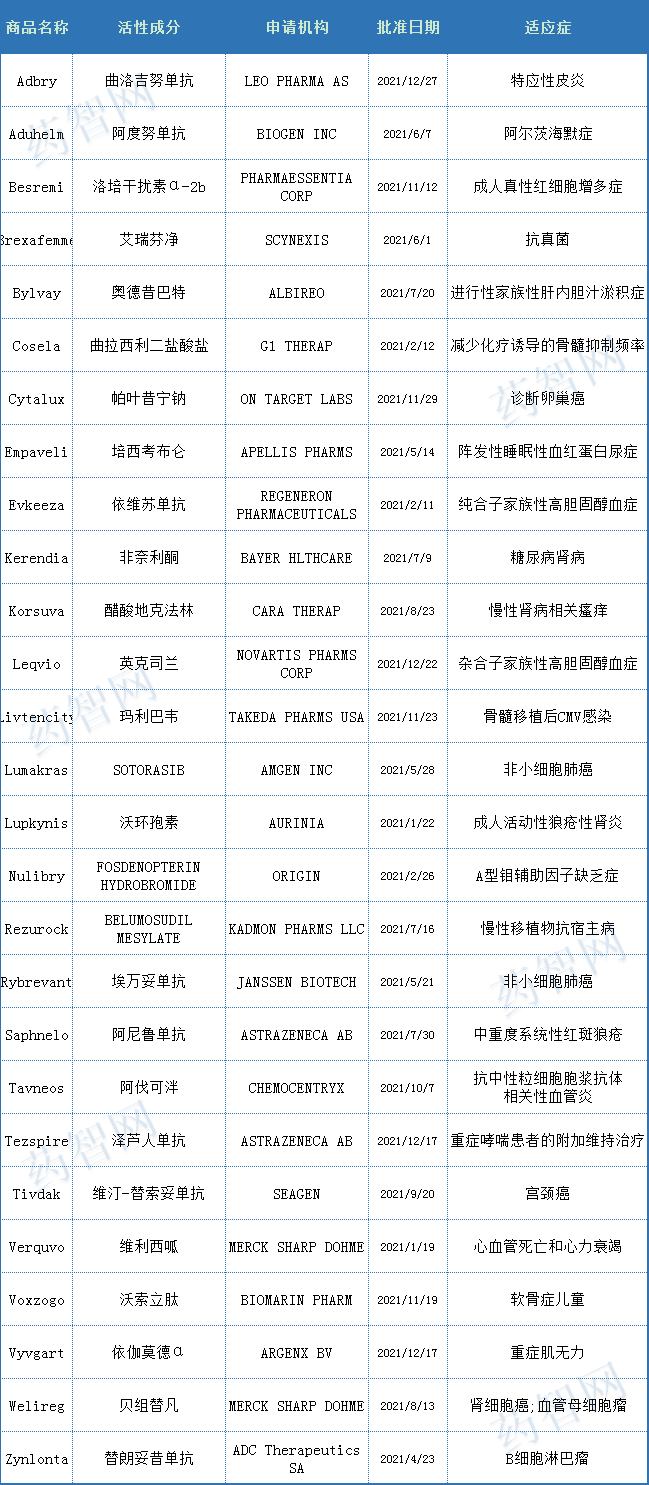
(来源:药智数据美国上市药品数据库)
首仿药(First Generics)及国内上市情况
首仿药即首次仿制药,FDA首次批准并允许制造商在美国销售此药。FDA认为第一个首仿药对公众健康很重要,并优先审查这些提交的文件。值得注意的是,FDA允许首仿药有180天的市场独占权。2021年超过80款药物,被FDA界定为首仿药。
在本年度批准的首仿药系列中,上海复星医药旗下GLAND PHARMA LTD的盐酸替罗非班于2021年4月获得FDA首仿药上市批准。盐酸替罗非班主要用于治疗急性冠状动脉综合症。GLAND PHARMA LTD为中国独一家获得了FDA首仿药的批准企业。
孤儿药(Orphan Drugs)
根据药智美孤儿药与罕见病数据库统计,2021年度共计有35款获得FDA认定且已批准上市,美国FDA允许孤儿药有7年的市场独占期。
“孤儿药”又称为罕见药,用于预防、治疗、诊断罕见病的药品,由于罕见病患病人群少、市场需求少、研发成本高,很少有制药企业关注其治疗药物的研发,因此这些药被形象地称为“孤儿药”。
FEXINIDAZOLE(非昔硝唑片)
非昔硝唑片是由赛诺菲开发的一种用于治疗昏睡病(非洲人类锥虫病),2021年7月16日获得批准上市。非洲人类锥虫病是一种由受感染的寄生虫引起的危及生命的疾病,在许多撒哈拉以南的非洲国家流行。 非西硝唑片是第一个口服治疗昏睡病的药物。(其他治疗包括口服成分与非口服药物联合服用。)
NULIBRY(FOSDENOPTERIN HYDROBROMIDE)
Nulibry 通过静脉注射给药方式可降低由A型钼辅助因子缺乏症(遗传性疾病)死亡风险,通常出现在生命的最初几天,导致难以控制的癫痫发作、脑损伤和死亡。Nulibry是第一个获批的用于治疗这种疾病的方法,于2021年2月26日获得FDA上市批准。
美国首批
美国首批即在其他国家批准之前在美国首次批准的药物。2021年,约42款新药为美国首次批准。Pradaxa(甲磺酸达比加群酯胶囊)最早在2010年10月获批,主要用于预防心房颤动、深静脉血栓形成、肺栓塞中的血栓栓塞。2021 年,CDER 扩大了Pradaxa的用途,以预防和治疗某些年仅8岁左右儿童患者的血栓。Pradaxa是FDA批准的第一个用于儿童类的口服血液稀释药物。
中国药企
2021年度,中国药企继续保持在FDA获批上市的良好态势,其中复星医药旗下的GLAND PHARMA LTD通过了14个ANDA的上市批准,取得中国药企在FDA获批数量的第一名。GLAND PHARMA LTD位于印度海德拉巴,是一家国际化并拥有原研药及制剂研发生产能力成熟规范的仿制药注射剂龙头企业,产品主要售向美国,2017年9月被复星医药收购。

图三 2021年度中国药企主要在FDA上市的品种排行(前十)
(来源:药智数据美国上市药品数据库)
除复星医药之外,南京健友、景峰医药、浙江华海等企业也不甘落后,陆续有多款药物在FDA上市。2021年中国药企在FDA上市的药品剂型中,数量最多的仍然是注射剂,其次片剂。
热门检索:米诺地尔和普瑞巴林
根据药智企业版数据分析系统:米诺地尔和普瑞巴林成为2021年企业版用户在检索美国FDA上市药品数据库中最热门的药物。可见,高血压和神经精神类疾病领域是国内制药企业关注的热点,2021年度有超过20家国内企业在上述领域进行仿制药生产研究。
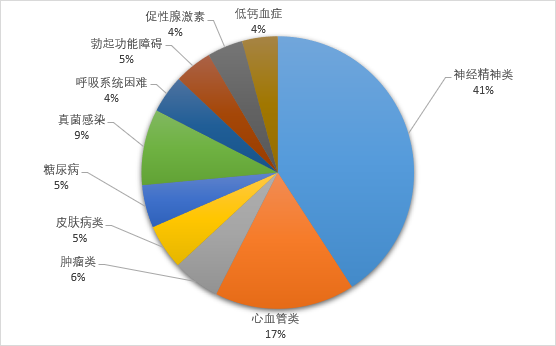
图四 2021年国内制药企业重点关注的疾病领域(列举前十)(来源:药智数据美国上市药品数据库)
<米诺地尔>
米诺地尔最早是由法玛西亚普强公司(辉瑞子公司)开发用于治疗溃疡,但动物实验中发现溃疡并未被治愈,却被证明是一个强大的血管舒张剂,通过直接引起外周动脉血管舒张来治疗高血压。1979年,FDA首次批准米诺地尔(商品名Loniten)口服片剂用于治疗高血压。与此同时,米诺地尔还可以用来治疗脱发,并且在临床上也在广泛应用。
表二 2021年度FDA批准对含米诺地尔的药物(按照申请机构浏览)
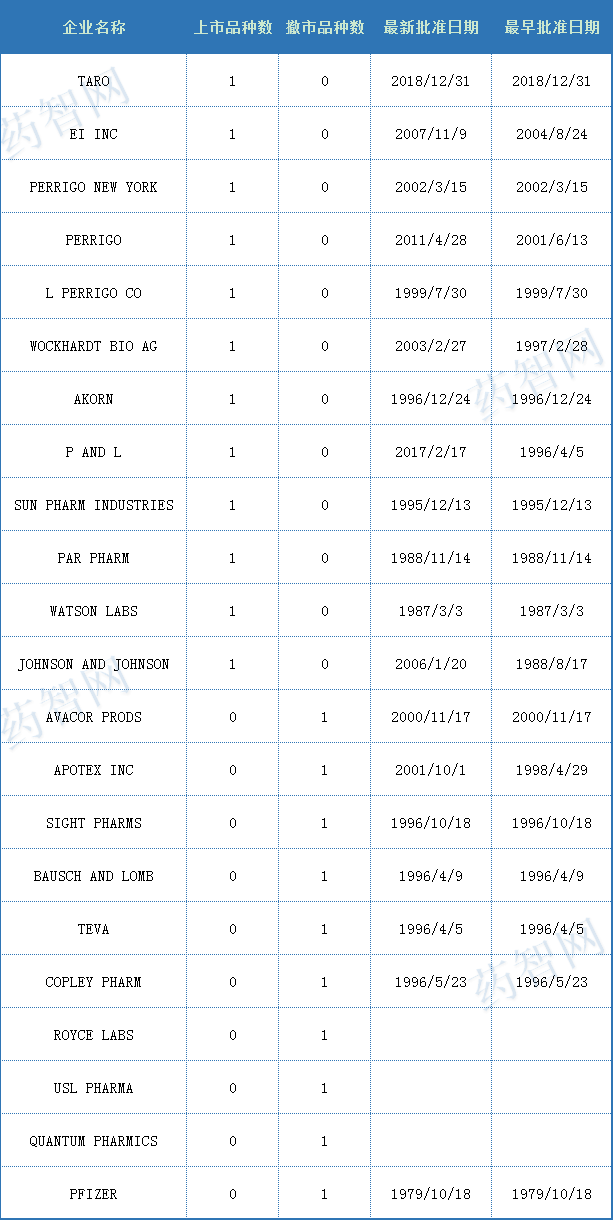
(来源:药智数据美国上市药品数据库)
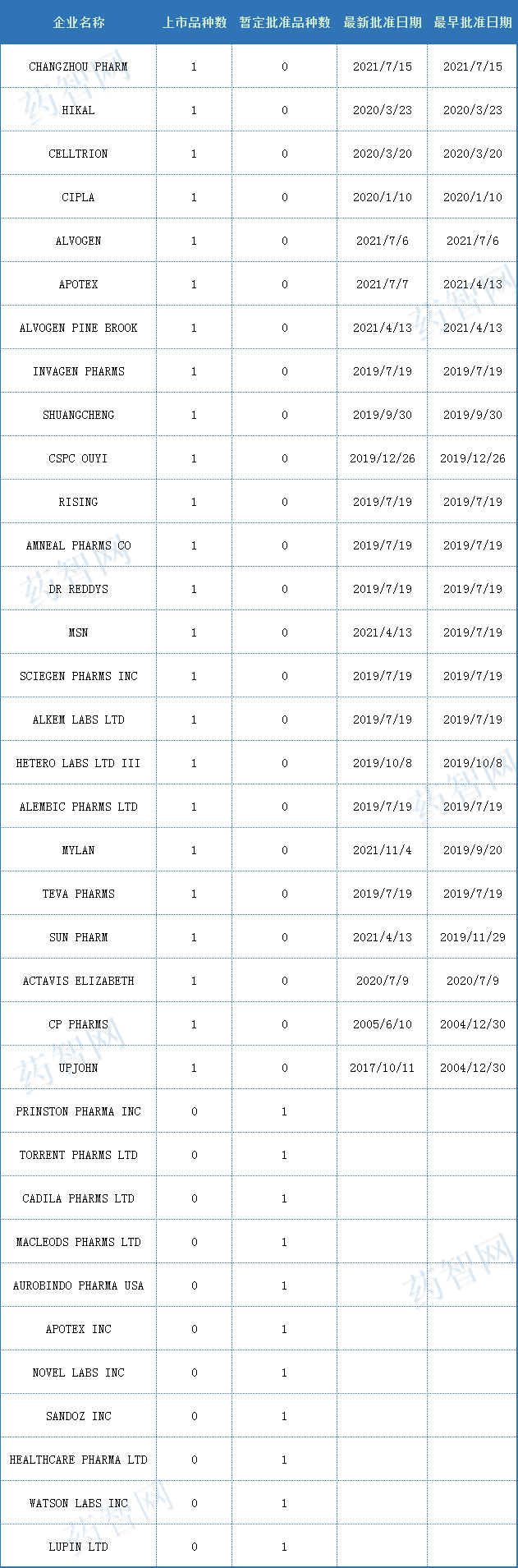
<普瑞巴林>
普瑞巴林是由辉瑞研发的一种新型的γ-氨基丁酸(GABA)受体激动剂,用于治疗糖尿病性外周神经病变(DPN)或脊髓损伤导致的神经疼痛,带状疱疹后遗神经痛(PHN)、纤维肌痛和癫痫发作。普瑞巴林最早于2004年7月6日获EMA批准上市,商品名为Lyrica,FDA在2004年12月30日批准上市, 2010年4月16日获日本PMDA批准上市。
表三 2021年度FDA批准含普瑞巴林的药物(按照申请机构浏览)
(来源:药智数据美国上市药品数据库)
数据来源:药智数据美国上市药品数据库、药智孤儿药与罕见病数据库、 Drugs@FDA

责任编辑:琉璃
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






