【药咖君】国内第14款PD-1获批!丽珠30亿大单品申报新适应症,乐普生物、人福…
本周看点
1、国内第14款PD-1获批!来自乐普生物
2、人福医药「瑞马唑仑」获批新适应症
3、丽珠医药核心品种艾普拉唑申报新适应症
4、BMS首款TYK2抑制剂国内提交上市申请
本期(7月15日至7月22日),乐普生物PD-1单抗获批上市,系国内第14款;人福药业麻醉新药「瑞马唑仑」获批新适应症;PPI抑制剂注射用艾普拉唑钠提交新适应症上市申请;多款重磅新药报产新进展,更多动态如下:
国内审评审批·新动态
本期CDE有26个受理号(22个品种)报生产办理状态更新,其中人福药业的注射用苯磺酸瑞马唑仑和乐普生物的普特利单抗注射液优备受关注。更多动态如下:
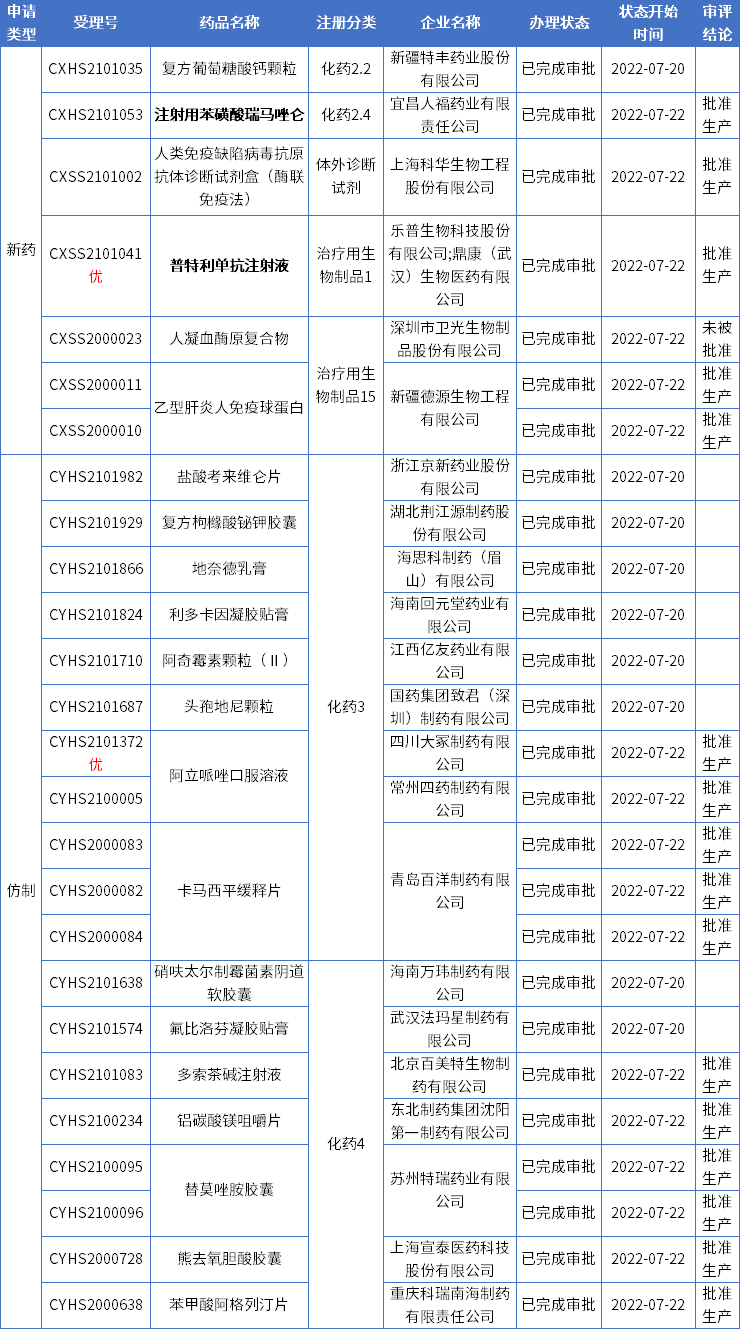
数据来源:药智数据
国内第14款PD-1获批!来自乐普生物
7月22日,乐普生物研发的抗PD-1单克隆抗体——普佑恒™(普特利单抗注射液)获NMPA附条件批准上市,适应症为:用于既往接受一线及以上系统治疗失败的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR) 的晚期实体瘤患者的治疗。药智数据显示,这是国内获批的第14款PD1/PD-L1单抗。
国内已上市PD-1/PD-L1单抗获批适应性情况
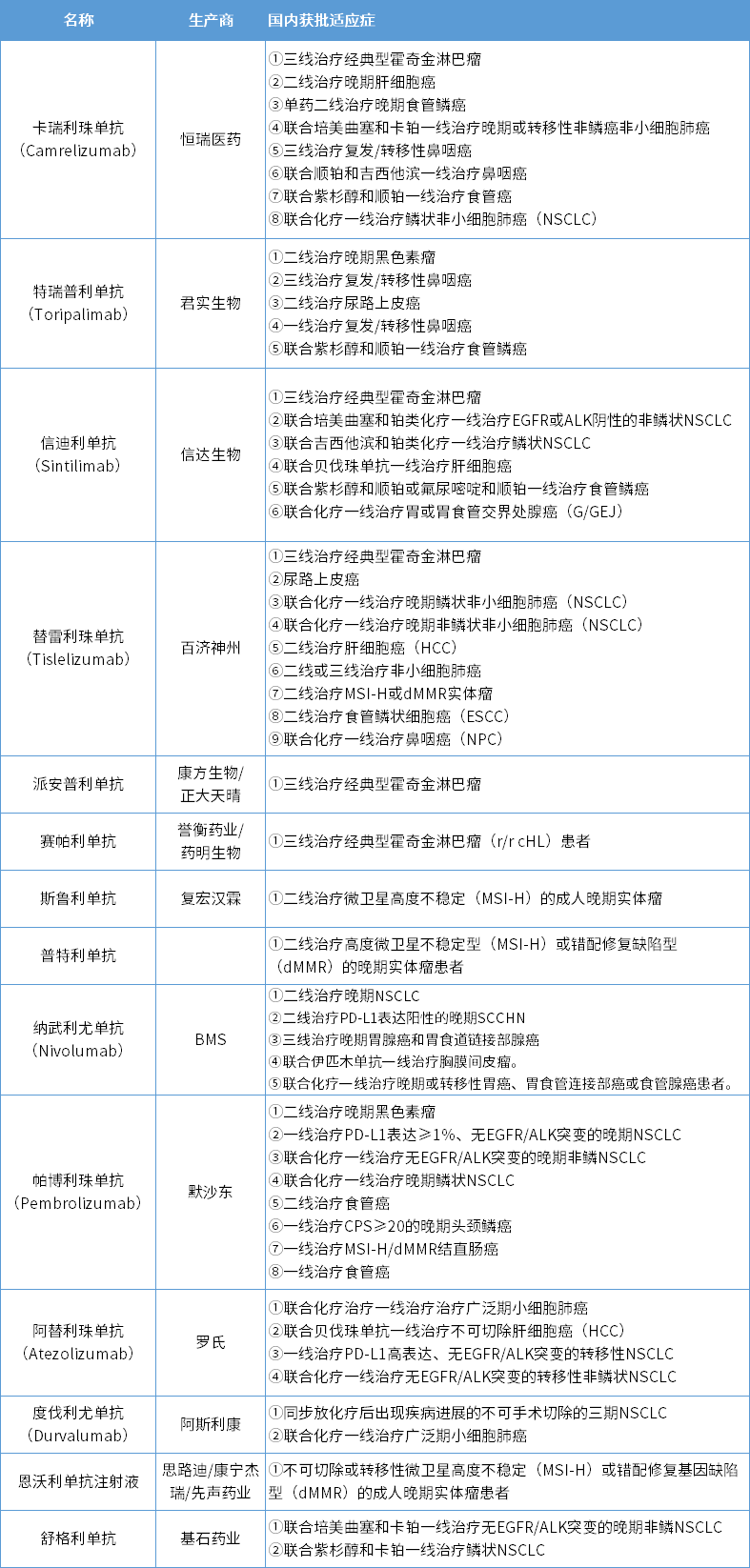
数据来源:药智数据
据乐普生物新闻稿,普特利单抗可高亲和力与PD-1结合,以通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。普特利单抗注射液采用创新分子设计以延长其半衰期,显示出强大的临床抗肿瘤活性以及良好的安全性。
此次获批主要是基于一项多中心、开放、II期临床研究的客观缓解率(ORR)。截至2021年12月4日,ORR为49.0%(95%CI:38.86%, 59.20%);既往三药(氟尿嘧啶类、奥沙利铂和伊立替康)治疗失败的结直肠癌亚组中,ORR为50.0%(95%CI:31.30%, 68.70%)此前该项适应症上市申请被CDE纳入优先审评。
此外,普特利单抗二线治疗黑色素瘤的上市申请已于2021年7月获得CDE正式承办受理,目前处于审评审批阶段。在国际化方面,2022年1月取得美国FDA对于普特利单抗治疗晚期实体瘤的IND批准。
人福医药「瑞马唑仑」获批新适应症
7月22日,人福医药麻醉新药「注射用苯磺酸瑞马唑仑」新适应症获NMPA批准上市。这是该产品上市的第3项适应症,推测适应症为:支气管镜诊疗镇静。
注射用苯磺酸瑞马唑仑是由宜昌人福联合德国PAION公司共同开发的一种新型的超短效静脉注射苯二氮卓类镇静药,为超短效GABAa受体激动剂,具有水溶性和消除半衰期短的特点。2020年7月,该产品首次在国内获批上市,用于结肠镜检查的镇静。2022年3月,扩展新适应症,用于治疗全身麻醉诱导与维持。
国内审评审批·新受理
本期CDE新增报生产受理号57个,共43个品种,其中亚盛医药/信达生物的奥雷巴替尼片、丽珠医药的注射用艾普拉唑钠,以及百时美施贵宝的氘可来昔替尼片备受关注,更多动态见下表:

数据来源:药智数据
亚盛医药「奥雷巴替尼」治疗耐药CML上市申请获受理
药智数据显示,亚盛医药提交的奥雷巴替尼(商品名:耐立克)2.4类新药上市申请已获CDE受理并被纳入优先审评程序,用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药和/或不耐受的慢性髓细胞白血病慢性期(CML-CP)患者。
奥雷巴替尼是亚盛医药开发的原创1类新药,为口服第三代BCR-ABL抑制剂,是中国首个获批上市的第三代BCR-ABL靶向耐药CML治疗药物,曾获国家“重大新药创制”专项支持。2021年11月,NMPA通过优先审评审批程序附条件批准耐立克®(奥雷巴替尼)上市申请,用于治疗用于任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I 突变的慢性髓细胞白血病慢性期 (CML-CP) 或加速期 (CML-AP) 的成年患者。
此次受理及纳入优先审评是基于一项开放、随机对照的确证性关键注册II期研究(HQP1351CC203研究)。2021年3月CDE已基于此项研究将耐立克®纳入突破性治疗品种。
此外,奥雷巴替尼还获得了1项美国食品药品监督管理局(FDA)审评快速通道资格;3项美国FDA孤儿药资格认定,适应症分别为CML,急性淋巴细胞白血病(ALL)和急性髓系白血病(AML);还获一项1项欧洲药品管理局(EMA)的欧盟孤儿药资格认定,适应症为CML。
2021年7月,亚盛医药(6855.HK)与信达生物制药集团(1801.HK)达成在中国市场就耐立克®共同开发和共同商业化推广的战略合作。
丽珠医药核心品种艾普拉唑申报新适应症
药智数据显示,丽珠制药提交的一项注射用艾普拉唑钠2.4类新药上市申请已获CDE受理,推测适应症为预防重症患者应激性溃疡出血。
艾普拉唑属于不可逆型的质子泵抑制剂(PPI),是丽珠集团核心大品种。目前,市场上的PPI药物主要有两代6种:包括第一代产品:奥美拉唑、兰索拉唑、泮托拉唑;第二代产品:雷贝拉唑、艾司奥美拉唑、艾普拉唑。六大PPI药物中,仅有艾普拉唑是由我国药企(丽珠集团)自主研发,目前仍是独家产品。
丽珠集团曾在新闻稿中表示,艾普拉唑较同类 PPI 药品相比优势明显,剂量小、起效快、作用持久、安全性高、代谢机制独特无个体差异。注射用艾普拉唑钠于2018年1月获批上市,功能主治/适应症:消化性溃疡出血,于2019年11月通过谈判首次纳入《医保目录》,近3年销售增速均达三位数。
2021年,艾普拉唑系列(口服肠溶片+注射液)销售收入约30亿元。今年一季度,预计艾普拉唑针剂销量同比增长超过50%,片剂销量同比增长超过30%。新适应症的上市预计还将继续带来增长。
BMS首款TYK2抑制剂国内提交上市申请
近日,百时美施贵宝按化药1类新药申报的氘可来昔替尼片(deucravacitinib,BMS-986165)的上市许可申请获CDE受理,推测适应症为中至重度斑块状银屑病。
氘可来昔替尼是BMS自主研发的首个口服、选择性酪氨酸激酶2(TYK2)的变构抑制剂。不同于已知的JAK抑制剂,氘可来昔替尼可高度选择性地与TYK2的假激酶结合域(pseudokinase domain,JH2)结合,通过分子变构机制抑制TYK2激酶的活性,且对JAK1、JAK2和JAK3的抑制能力较弱,这会有效降低因JAK1、JAK2和JAK3抑制而导致的不良反应事件。此前,FDA受理了氘可来昔替尼用于治疗成人中至重度斑块型银屑病的上市申请,PDUFA日期定为2022年9月10日。如果获批,氘可来昔替尼将成为首个获批上市的TYK2抑制剂。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息
「新闻时讯、深度评论、咨询报告、线上直播、学术会议... 一键获取!
找工作、招人才、查数据、找供应商、悬赏交易、信息发布,点击“药智网”,一网打尽~」

责任编辑:琉璃
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






