白云山羧甲司坦片终止注册,一致性评价已投入超300万
2月1日,白云山公告,称其分公司白云山制药总厂收到国家药监局的审批意见通知件,同意白云山制药总厂申报药品一致性评价的羧甲司坦片撤回注册申请,终止注册程序。
据药智数据显示,白云山制药总厂申报一致性评价的羧甲司坦片在2018年10月12日获得受理,在2019年1月17日审评结论显示不批准。再看羧甲司坦片的BE开展状态,临沂山松药业在2019年1月开始BE备案,目前正在招募状态。

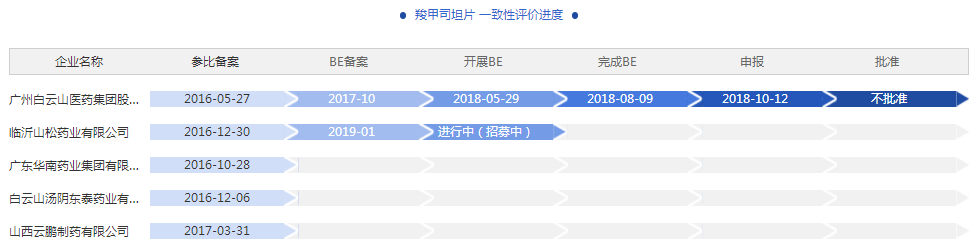
数据来源:药智数据
公告显示,羧甲司坦是一种呼吸道粘液溶解剂,用于治疗慢性支气管炎、支气2管哮喘等疾病引起的痰液粘稠、咳痰困难患者。羧甲司坦于 1965 年由法国 Sanofi 公司开发上市,1981 年在日本上市,1985 年在我国上市。
羧甲司坦制剂 2017 年全球销售额约为美元 3.68 亿(数据来源 Pharmarket),白云山制药总厂产品羧甲司坦片于 1986 年获得国内上市批准,2017 年销售收入为人民币 497.37 万元,占白云山制药总厂 2017 年度营业收入的0.22%,占公司 2017 年度营业收入的 0.02%。
白云山制药总厂于 2018 年 9 月 30 日向国家药品监督管理局提交羧甲司坦片一致性评价的补充申请。按照一致性评价审评审批法规要求,经研究,白云山制药总厂认为该项目 BE 研究的批量较小且产品储存条件与参比制剂有差异,故于 2018 年 12 月 25 日主动申请撤回。截至 2018 年 12 月,白云山制药总厂针对该药品一致性评价已投入研发费用为人民币332.31万元。公告全文如下:


声明:本文系药智网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






