2016年FDA批准新药汇总
在2016年,FDA批准的新药包括脊髓性肌萎缩患者的首次治疗药物、第一个被批准治疗Duchenne肌营养不良症的药物、一种治疗帕金森病患者幻觉和妄想的新药、一种治疗罕见的慢性肝病(被称为原发性胆汁性肝硬化)的患者的新药以及对丙型肝炎患者的两种新疗法。还包括用于卵巢癌,膀胱癌,软组织肉瘤和慢性淋巴细胞性白血病患者的新治疗以及用于检测某些形式的癌症的两种新的诊断试剂。
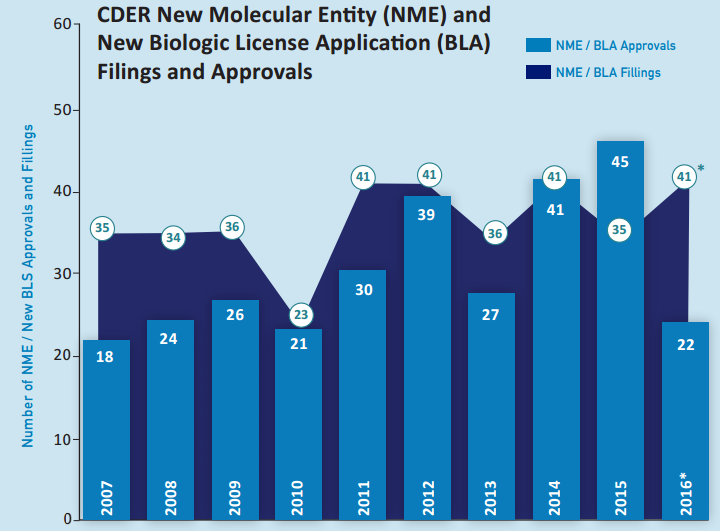
FDA的药物评价和研究中心(CDER)在2016年批准的新药低于平均数,但是新药的申报数量一直保持相对稳定。下边图形的阴影部分表示过去十年每年新分子实体(NME)的新NDA和生物制品许可申请(BLA)的申请数量,垂直条表示过去十年每年CDER批准的新药的数量。从2007年到2015年,CDER每年平均提交约36份新药申请,CDER估计2016年有41份申请。
CDER在2016年批准了22种新药。从2007年到2015年,CDER平均每年约有30种新药批准。
在2016年批准的22种新药物中的许多是对医疗和公共卫生有着显著的或潜在的积极影响和独特的贡献。接下来从以下几个方面来看2016年FDA批准的新药详情:
一流新药
CDER确定了2016年批准的22种新药中的8种(占比36%)为一流,这是创新性药物的一个指标。这些药物通常具有不同于现有治疗方法的作用机制。包括以下药物:Defitelio、Exondys51、Ocaliva、Spinraza、Venclexta、Xiidra、Zinbryta、Zinplava。

值得注意的一流药物包括:
Defitelio—治疗发展为肝静脉闭塞性疾病和造血干细胞移植(HSCT)后有肾或肺功能失调成年和儿童患者。
Zinbryta—治疗多发性硬化症。
罕见疾病药物
在2016年批准的22种新药中有9种(占比41%)被批准用于治疗影响20万或少数美国人的罕见或“孤儿”疾病。这是很有意义的,因为患有罕见疾病的患者通常很少或没有药物来治疗其病症。包括以下药品:Anthim、Defitelio、Exondys51、Lartruvo、Netspot、Ocaliva、Rubraca、Spinraza、Venclexta。

在2016年新药中治疗罕见疾病的药物的值得注意的实例包括:
Exondys51—治疗Duchenne肌营养不良的患者;
Spinraza—用于治疗脊髓性肌萎缩的患者。
除了在上面提到的创新的一流和“孤儿”新产品的值得注意的例子,2016年新药领域还包括其他值得注意的药物。这些包括癌症治疗:Lartruvo治疗患有称为软组织肉瘤的癌症形式的患者;Rubraca,晚期卵巢癌新治疗;Tecentriq,治疗患者最常见类型的膀胱癌(尿路上皮癌)和Venclexta用于治疗某些慢性淋巴细胞白血病患者。同样值得注意的是两种诊断剂,Axumin用于帮助检测前列腺癌的显像剂,Netspot用于检测罕见的神经内分泌肿瘤的另一种显像剂。
2016年的新药批准还包括两种新的丙型肝炎治疗方案—Epclusa,用于治疗所有六种主要形式的丙型肝炎病毒;Zepatier,治疗感染慢性丙型肝炎病毒基因1和4型的成人患者。
另外值得注意的批准包括Nuplazid,用于治疗帕金森患者出现幻觉、妄想等相关精神症状;Ocaliva,用于治疗患有罕见的慢性肝病(称为原发性胆汁性肝硬化)的患者。
FDA用于向市场推出药物的创新方法
在2016年,CDER使用了一些监管方法来加速新药的开发和批准,包括:快速通道、突破、优先审评、加速审批。
快速通道
快速通道的药物有潜力解决未满足的医疗需求。2016年有8种新药(占比36%)被指定作为快速通道。例如,通过提高FDA分配给药物开发商的沟通水平,以及使CDER能够在提交完整申请之前审评一部分药物申请,FastTrack加速了新药开发和审评。包括以下药物:Anthim、Defitelio、Epclusa、Exondys51、Lartruvo、Ocaliva、Spinraza、Zinplava。
突破性治疗
突破性治疗是具有初步临床证据的药物,表明药物可导致大量的对至少一个临床上显着的终点(例如研究结果)的改善超过其他可用的治疗。CDER指定2016年的7种新药(占比32%)作为突破性疗法。一个突破性的治疗指定包括所有的快速通道计划功能,以及更有力的FDA指导高效的药物开发计划。
突破性治疗旨在帮助缩短潜在新治疗的开发时间。包括以下药物:Epclusa、Lartruvo、Nuplazid、Rubraca、Tecentriq、Venclexta、Zepatier。
优先审评
如果CDER确定药物可能潜在地为医疗保健提供显著的进步,药物将获得优先审评。药物在六个月内而不是标准的10个月内进行复查。2016年有15个新药(68%)被指定为优先审评。包括以下药品:Axumin、Defitelio、Epclusa、Exondys51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Tecentrique、Venclexta、Xiidra、Zepatier、Zinplava。
加速批准
加速审批程序允许早期批准用于严重或威胁生命的疾病的药物,其提供比目前治疗有益的药物。CDER根据加速审批计划批准了2016年新药中的6种(27%)。该批准基于我们认为合理可能预测药物的临床益处的“替代终点”(例如实验室测量)或其他临床测量。一旦批准加速批准,药物必须进行额外的测试以确认该益处。这加速了药物对需要它的患者的可用性。包括以下药物:Exondys51、Lartruvo、Ocaliva、Rubraca、Tecentriq、Venclexta。
加快发展和审评方法小结
2016年新药中共有16种(73%)被指定为快速通道的一个或多个快速类别,突破性治疗、优先审评和/或加速审批(详情见下图)。每个这些指定都有助于加快开发和/或批准过程的速度,并且旨在帮助尽快将重要的药物推向市场。包括以下药物:Anthim、Axumin、Defitelio、Epclusa、Exondys51、Lartruvo、Netspot、Nuplazid、Ocaliva、Rubraca、Spinraza、Tecentriq、Venclexta、Xiidra、Zepatier、Zinplava。


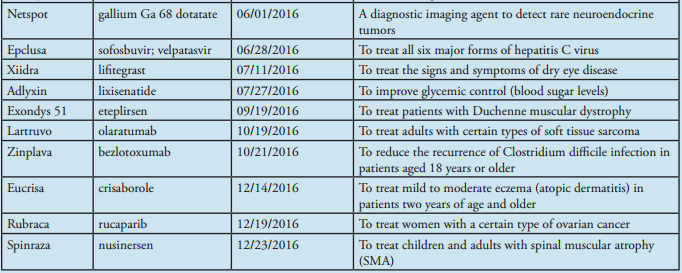
2016年CDER批准的新药(按批准日期排列)

注:本文系药智网翻译稿件,欢迎转载,转载请注明来源,谢谢!




合作
 扫码关注-药智网公众号
扫码关注-药智网公众号Copyright © 2009-2025 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938



