恒瑞医药再抢热度,PD-1单抗新获两大适应症III期临床批件
7月16日,恒瑞医药发布公告称,已于近日收到国家药品监督管理局核准签发的注射用卡瑞利珠单抗(SHR-1210)联合疗法的《临床试验通知书》。

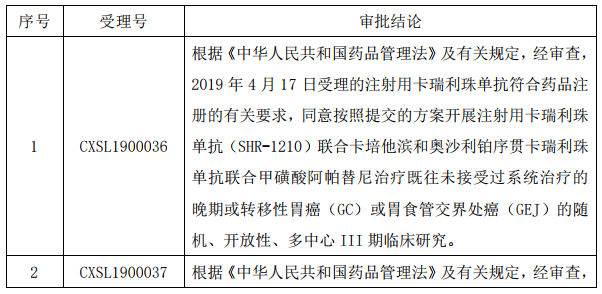

卡瑞利珠单抗(SHR-1210)是人源化抗 PD-1 单克隆抗体,可与人 PD-1 受体 结合并阻断 PD-1/PD-L1 通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治 疗基础。2019 年 5 月,公司注射用卡瑞利珠单抗获得了复发难治性经典型霍奇 金淋巴瘤的适应症的上市批准。
经查询,抗 PD-1 抗体国外目前有同类产品 Nivolumab、Pembrolizumab 及 Cemiplimab-rwlc 已获批上市。Nivolumab 由 BRISTOL MYERS SQUIBB 公司开发, 商品名为 Opdivo,最早于 2014 年在美国获批上市;Pembrolizumab 由 Merck Sharp & Dohme 公司开发,商品名为 Keytruda,最早于 2014 年在美国获批上市; Cemiplimab-rwlc 由 Regeneron 和 sanofi-aventis 公司共同开发,商品名为 Libtayo,最早于 2018 年在美国获批上市。其中的两种药品 Nivolumab、 Pembrolizumab 目前已在国内获批上市。国内目前由信达生物和君实生物开发的 同类抗 PD-1 单抗注射液已于 2018 年获批上市,百济神州等企业的相关药品正处 于上市申请审批阶段。
经查询 IMS 数据库,2018 年抗 PD-1 抗体全球销售额约为 1,417,802 万美元, 国内销售额约为 643.75 万美元。 截至目前,该产品项目已投入研发费用约为 54,866 万元人民币。
声明:本文系药智网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






