后基因组时代,新药研发真的很需要“它”!
自2014年夏季,在李克强总理提出“大众创业、万众创新”的口号之后,中华大地960万平方公里的土地掀起了创业的新浪潮以及创新的新势态。制药行业虽为传统行业,但创新的势头也开始逐渐显现出来,全国各大制药企业、科研院所也在多年药品仿制的主流状态中,开始推进创新药物的研制以及研发方向的转型,并取得了不错的成绩。
创新药不同于仿制药,无论是学科涉及面或是产品开发的思路等,都存在较大的差异,创新药需要更多学科及技术来支撑、支持,计算机辅助药物设计(computeraideddrugdesign,CADD)就是其中之一。CADD作为当今药物研发的重要工具,在创新药的开发过程中,不仅为药物的设计提供了很好的指导思路,而且还节省了大笔的科研经费,可以说,它的应用对于化合物的“成药”,通常能起到事倍功半的作用。今天,我们就共同聊聊CADD在新药研发方面的作用,看看它到底是如何助力于创新药物的开发!
1.后基因组时代,药物研发模式是怎样的?
我们先来了解下,后基因组时代药物研发的模式。首先,科研工作者要通过研究功能基因组及其分子水平上与疾病相关的发病机制,来寻找和确证药物作用的靶标;其次,通过药物筛选,包括借助基于组合化学为基础的高通量筛选,或者基于配体和基于结构的高通量虚拟筛选的方法,寻找有潜力的先导化合物并进行生物活性的测试;再次,综合运用结构生物学,分子对接、定量构效关系、药效团等方法,分析药物与受体的构效关系,进一步优化先导化合物分子水平与细胞水平的活性;通过对候选药物的药效、药物代谢动力学的吸收、分布、代谢、排泄和毒性并结合动物体内体外实验数据来进行评价;最终,药物经过I、II、III、IV期的临床试验,确证其有效性和安全性,经注册批准后进入市场上市销售。
CADD技术可应用到药物研发流程中的大部分环节之中,并且利用这项技术可以在缩短药物研发周期的同时也可相应地减少研发费用,该技术已经被国外许多制药公司广泛用于创新药物的研发,且已经取得了极大的成功。据统计,由于分子模拟和计算机辅助药物设计的介入,使得新药研发的周期缩短了0.9年,直接研发费用降低了1.3亿美元。
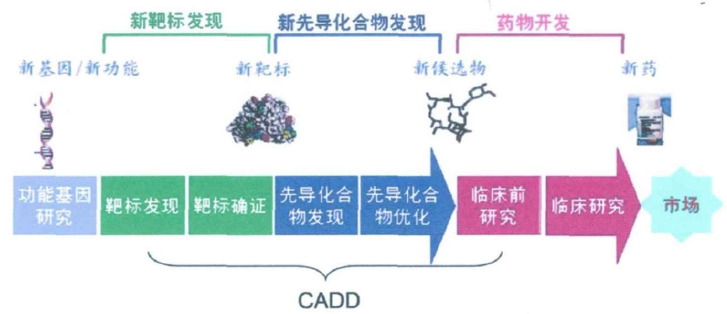
图一:后基因组时代药物研发流程示意图
2.那么,到底什么是CADD?
简言之,CADD就是以计算机化学为基础,通过计算机的模拟、计算和预算药物与受体生物大分子之间的关系,设计和优化先导化合物的方法。也就是通过模拟和计算受体与配体的这种相互作用,进行先导化合物的优化与设计。
在整个药物开发过程中,CADD技术可以简化药物发现和开发的过程,利用配体/受体靶标的化学和生物学信息识别和优化新的药物,以及设计电脑虚拟过滤器来排除具有不良特性的化合物(如活性较低和/或吸收、分布、代谢、排泄和毒性特性较差的化合物),并选择最有前途的先导化合物。
与传统的实验手段相比,CADD技术除了具有高效率、低成本和低投资等优点外,还能够减少传统药物设计的盲目性和偶然性,为改进现有化合物的结构,设计新的化合物,提供理论上的指导和思路。伴随着组合化学技术和生命科学研究的深入以及人类基因组计划的完成,CADD技术在新药研究特别是先导化合物的发现和优化中将发挥着越来越重要的作用。
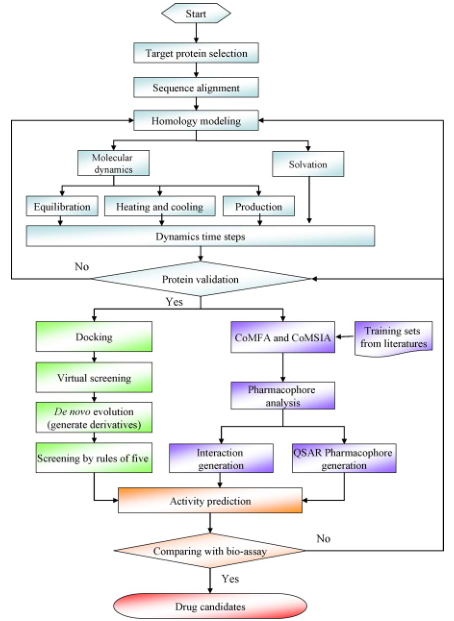
图二:CADD流程的举例
3.CADD都有哪些方法?
CADD的理论基础是药物-受体作用假说和分子模拟,因此根据受体的结构是否已知,CADD技术大致可以分为:基于配体的药物设计(ligand-baseddrugdesign)和基于受体的药物设计(receptor-baseddrugdesign)。
对于基于配体的药物设计方法,也叫间接药物设计方法,是指在未知受体结构信息的
情况下,从现有的具有生物活性的药物分子出发,通过构建定量构效关系(QSAR)或药效团模型等,分析药物分子结构特征、理化性质等与生物活性大小的关系,反推受体活性位点的结构需求,从而设计和优化出与受体结合位点尽可能相匹配的小分子化合物。该方法主要包括QSAR和药效团模型等。
QSAR通常只能用于研究一系列具有共同骨架的化合物,所得到的结果一般也只能用于该系列化合物的活性预测或者指导该系列化合物的改造和优化。而药效团模型则可以运用于不同骨架化合物的研究,只要求这些化合物是以相同的方式作用于同一受体靶点,只要这些化合物具有某一特定药效团特征,那么就有可能具有某种生物功能,因此药效团模型方法可以用来寻找结构全新的先导化合物。
而对于基于受体的药物设计,即直接药物设计方法,主要包括分子对接和包括分子动力学模拟在内的全新药物设计。基于受体的药物设计是指根据已知的药物作用靶标如蛋白质、核酸等生物大分子的三维结构信息,用理论计算和分子模拟等方法得到配体小分子和受体结合的复合物结构,从而预测小分子-受体的相互作用模式,并以此设计能够与受体匹配良好的新型小分子。其中,分子对接技术是基于受体的药物设计的核心。
“锁匙模型”是分子对接理论的原型。所谓的分子对接技术是指将配体小分子置于生物大分子的活性空腔中,通过不断优化配体和受体的相对位置、空间取向以及分子内部可旋转键的二面角等,进而实现配体与受体分子之间的空间识别和能量识别,并通过打分函数的高低确定出与受体结合最佳的药物配体分子的一种有效的药物虚拟筛选技术。而全新药物设计方法是根据靶标分子与药物分子相结合的活性部位(“结合口袋”)的几何形状和化学特征,设计出与其相匹配的具有新颖结构的药物分子。
4.展望:
CADD技术作为一种将结构生物学、药物化学与高性能计算结合起来的交叉学科,在过去几十年的发展中取得了巨大的进步。这项技术己被成功地运用于药物研发中,且缩短了新药研发的周期、降低了新药研发的成本。但目前CADD许多模拟测试的准确度还有待提升,技术还不够成熟,存在一定的局限性,这也许正是其在国内创新药物研发过程中应用的普遍性还不够强的原因。不过,相信随着CADD技术的逐渐完善,在未来新药开发的过程中,CADD技术必将成为一把利器!
参考文献:
1. Ng L, Chong F, NG C. Challenges and opportunities in computer-aided molecular design[J]. Computers & Chemical Engineering, 2015, 81: 25–34.
2.黄春娥. P38 MAPK抑制剂的计算机辅助药物研究[D]. 大连理工大学, 2013.
3. Austin N, Nikolaos V,Daniel W. Computer-aided molecular design: An introduction and review of tools, applications, and solution techniques[J]. Chemical Engineering Research and Design, 2016.
4.曹贤文. FGFRI选择性小分子抑制剂靶标识别及定量构效关系研究[D]. 华东理工大学, 2012.
5. Huang H,Yu H,Chen C, et al.Current developments of computer-aided drug design[J].Journal of the Taiwan Institute of Chemical Engineers, 2010, 41(6):623-635.
注:本文系药智网作者原创,欢迎转载,转载时请注明出处和作者,谢谢!

研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938






