CDE电子刊物:2006-2016年临床试验指导文件大全
临床试验是指通过人体志愿者也称为受试者进行的生物学科学研究。根据试验目的等不同,受试者可能是患者或健康志愿者。药物临床试验是用来研究药物的有效性、安全性和质量等问题,以考察其能否上市用于特定人群的临床试验。
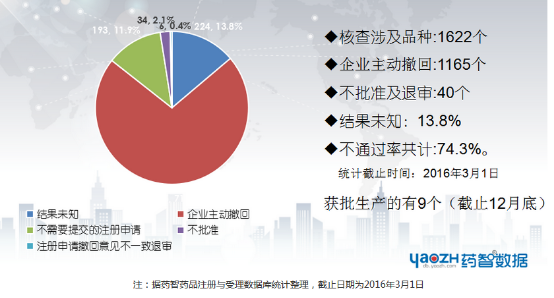
去年7.22,CFDA公布《开展药物临床试验数据自查核查》的公告,在行业内掀起了狂风巨浪,1622个品种被核查,企业主动撤回1165个,不批准及退审40个,未通过率高达74.3%。不难发现,随着国家对药品审核监管力度的加大,药企发展不再是曾经那么顺风顺水了。药物申报受理的收紧、临床资源的紧缺、高昂的临床试验费用、无法预料的前景……让不少制药企业步履维艰。
严政笼罩之下,如何很好地在临床试验上运筹帷幄,领会到临床试验研究的内在精神,这需要制药企业们深练内功的前提下深入了解国家相关法律法规、指导文件,并对其进行全面深刻解读。下面是通过药智数据政策法规数据库(http://db.yaozh.com/policies)统计的CDE电子刊物2006-2016年10年间的临床试验法规及指导文件,输入“临床试验”关键词,所有内容一目了然,对药企在临床试验运作方面大有裨益。具体内容如下(点击标题名称可查看全文):
序号 | 法规标题 | 发布日期 |
1 | 2016.03.01 | |
2 | 2016.02.26 | |
3 | 2015.12.01 | |
4 | 2015.07.01 | |
5 | 2015.06.01 | |
6 | 2014.04.04 | |
7 | 2013.05.22 | |
8 | 2013.03.14 | |
9 | 2013.02.25 | |
10 | 2013.02.21 | |
11 | 2013.01.05 | |
12 | 2012.12.26 | |
13 | 2012.12.07 | |
14 | 2012.10.16 | |
15 | 2012.10.10 | |
16 | 2012.07.27 | |
17 | 2012.05.08 | |
18 | 2011.08.29 | |
19 | 2011.08.03 | |
20 | 2011.07.01 | |
21 | 2011.06.15 | |
22 | 2011.06.08 | |
23 | 2011.06.02 | |
24 | 2011.05.25 | |
25 | 2011.05.04 | |
26 | 2011.04.18 | |
27 | 2011.04.12 | |
28 | 2011.03.18 | |
29 | 2011.03.09 | |
30 | 2010.11.23 | |
31 | 2010.11.15 | |
32 | 2009.12.02 | |
33 | 2009.10.22 | |
34 | 2009.03.30 | |
35 | 2008.10.21 | |
36 | 2008.10.21 | |
37 | 2008.10.21 | |
38 | 2008.08.22 | |
39 | 2008.07.11 | |
40 | 2008.04.16 | |
41 | 2007.11.30 | |
42 | 2007.11.30 | |
43 | 2007.11.30 | |
44 | 2007.11.30 | |
45 | 2007.11.26 | |
46 | 2007.11.26 | |
47 | 2007.11.23 | |
48 | 2007.11.21 | |
49 | 2007.11.19 | |
50 | 2007.11.19 | |
51 | 2007.11.19 | |
52 | 2007.11.16 | |
53 | 2007.11.06 | |
54 | 2007.09.14 | |
55 | 2007.07.27 | |
56 | 2007.05.21 | |
57 | 2007.05.16 | |
58 | 2007.04.09 | |
59 | 2007.03.20 | |
60 | 2007.03.08 | |
61 | 2007.03.08 | |
62 | 2007.02.15 | |
63 | 2007.02.11 | |
64 | 2007.02.06 | |
65 | 2007.02.05 | |
66 | 2007.02.01 | |
67 | 2007.01.16 | |
68 | 2007.01.12 | |
69 | 2006.12.13 | |
70 | 2006.12.13 | |
71 | 2006.11.30 | |
72 | 2006.11.30 | |
73 | 2006.11.27 | |
74 | 2006.11.27 | |
75 | 2006.11.27 | |
76 | 2006.11.27 | |
77 | 2006.11.24 | |
78 | 2006.11.24 | |
79 | 2006.11.24 | |
80 | 2006.11.20 | |
81 | 2006.11.20 | |
82 | 2006.11.20 | |
83 | 2006.11.17 | |
84 | 2006.11.14 | |
85 | 2006.11.13 | |
86 | 2006.11.08 | |
87 | 2006.08.07 | |
88 | 2006.08.03 | |
89 | 2006.07.11 | |
90 | 2006.05.30 | |
91 | 2006.05.08 | |
92 | 2006.04.24 | |
93 | 2006.04.20 | |
94 | 2006.03.31 | |
95 | 2006.02.23 | |
96 | 2006.02.15 | |
97 | 2006.02.14 |


研发/政策栏目
小张 2512509353 15213063982药圈/会展栏目
小徐 838568582 18202350072商业/器械栏目
小洋 2108599521 18502370446前沿/报告栏目
小娟 368946684 17783467842合作
合作咨询
 扫码关注-药智头条
扫码关注-药智头条药智网旗下药智新闻订阅号
Copyright © 2009-2024 药智网YAOZH.COM All Rights Reserved. 工信部备案号:渝ICP备10200070号-3
 渝公网安备 50010802001068号
渝公网安备 50010802001068号投诉热线: (023) 6262 8397
邮箱: tousu@yaozh.com
QQ: 236960938





